题目内容
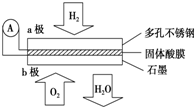 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A、电子通过外电路从b极流向a极 |
| B、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准下1.12 L的H2 |
| D、H+由b极通过固体酸电解质传递到a极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L.
解答:
解:A、因氢元素化合价升高失电子,则a为负极,这则电子是通过外电路由a极流向b,故A错误;
B、该电池为酸性电池,则正极的反应为O2+4e-+4H+=2H2O,故B错误;
C、根据反应为H2-2e-═2H+,每转移0.1mol电子,消耗标准下氢气是1.12L,故C正确.
D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D错误;
故选C.
B、该电池为酸性电池,则正极的反应为O2+4e-+4H+=2H2O,故B错误;
C、根据反应为H2-2e-═2H+,每转移0.1mol电子,消耗标准下氢气是1.12L,故C正确.
D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D错误;
故选C.
点评:本题考查燃料电池的工作原理,学习中要明确电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写问题,题目难度中等.

练习册系列答案
相关题目
下列金属材料中,最适合制造飞机外壳的是( )
| A、碳素钢 | B、镁铝合金 |
| C、铜合金 | D、铅锡合金 |
在指定环境中,下列各组离子一定可以大量共存的是( )
| A、加入铝可以产生H2的溶液中:Al3+、K+、SO42-、Cl- |
| B、在由水电离的c(OH-)=10-14mol?L-1 的溶液中:Fe2+、NH4+、NO3-、Cl- |
| C、在pH=11的溶液中:SO32-、K+、Na+、CO32- |
| D、在酸性溶液中:AlO2-、I一、NO3-、Na+ |
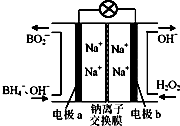 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、每消耗3 mol H2O2,转移的电子为3 mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
下列有关热化学方程式的叙述中,正确的是( )
| A、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1,;2C(s)+O2(g)═2CO(g)△H2;则△H1<△H2 |
下列关于胶体的说法正确的是( )
| A、胶体与其他分散系的本质区别是粒子直径的大小 |
| B、Fe(OH)3胶体能产生丁达尔效应 |
| C、明矾净水是利用胶体的吸附性 |
| D、雾、豆浆、淀粉溶液属于胶体 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、常温下,将5.6g铁投入到足量浓硝酸中,反应转移的电子数目为0.3NA |
| D、12 g金刚石中含有的共价键数为4 NA |
