题目内容
3.碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业.碳化法生产碳酸钡的工艺流程示意图如下:
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2.
回答下列问题:
(1)煅烧时发生反应的化学方程式为BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,该反应的氧化产物的电子式为
 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).(2)为了提高浸取速率,可采取的措施是适当提高温度(或搅拌等)(任写一种).
(3)碳化时发生反应的离子方程式为CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑.
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32-+BaS2O3=BaCO3+S2O32-,该反应的平衡常数为6.4×103【已知Ksp(BaCO3)=2.5×10-9,Ksp(BaS2O3)=1.6×10-5】.
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),用等式表示溶液中所有离子之间的关系:2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-).
(6)BaCO3不能用于医疗用的“钡餐”,原因是BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2,会使人中毒.
分析 重晶石和煤粉碎后煅烧粉碎反应生成硫化钡、二氧化碳,尾气主要是一氧化碳,反应后的固体浸取后通入二氧化碳预碳化,加入硫氢化钡溶液反应生成碳酸钡沉淀和硫化氢气体,碳酸钡脱硫后过滤干燥得到碳酸钡产品,
(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,氧化产物为二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,当温度过高时,尾气中有毒气体的含量会升高是高温下碳和二氧化碳反应生成有毒气体一氧化碳;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
(3)碳化时Ba(HS)2和二氧化碳气体发生反应生成碳酸钡沉淀和硫化氢气体;
(4)根据化学平衡常数为生成物的浓度幂之积与反应物的浓度幂之积之比列式,代入Ksp计算;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中存在电荷守恒;
(6)钡餐的主要成分是硫酸钡,硫酸钡难电离,在溶液中不能电离出有毒的钡离子,不会使人体中毒;碳酸钡能与稀盐酸反应生成可溶性的氯化钡,氯化钡能电离出有毒钡离子.
解答 解:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为: ,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
故答案为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑; ;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
故答案为:适当提高温度(或搅拌等);
(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
故答案为:CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})•c(B{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}$$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$=$\frac{1.6×1{0}^{-5}}{2.5×1{0}^{-9}}$=6.4×103;
故答案为:6.4×103;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
故答案为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒;
故答案为:BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2,会使人中毒.
点评 本题考查了物质制备工艺流程分析,主要是程度溶解平衡常数计算、电解质溶液中离子浓度大小比较、电荷守恒等知识点,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | S2-、K+、NO3-、SO42- | B. | H+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、K+、S2O32-、F- |
| A. | 化学反应过程中的能量变化除了热能外,还可以是光能、电能等 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
| A. | 装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸 | |
| B. | 滴加盐酸时滴到锥形瓶外 | |
| C. | 滴定达到终点时,振荡时待测液溅出锥形瓶 | |
| D. | 滴定前装盐酸的滴定管有气泡,滴定后气泡消失 |
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
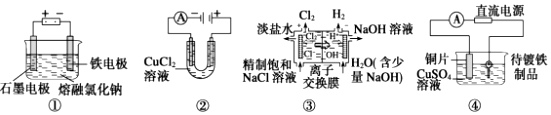
| A. | 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属 | |
| B. | 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝 | |
| C. | 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过 | |
| D. | 装置④的待镀铁制品应与电源正极相连 |

| A. | 实验I:实验室制备氨气 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:电解氯化铜溶液得到铜和氯气 |
 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法: