题目内容
2.下列各组离子在水溶液里能大量共存,但用盐酸酸化后,不能大量共存的是( )| A. | S2-、K+、NO3-、SO42- | B. | H+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、K+、S2O32-、F- |
分析 A.四种离子之间不反应,加入盐酸后硝酸根离子能够氧化硫离子,不能共存;
B.氢离子与碳酸氢根离子反应;
C.四种离子之间不反应,加入盐酸后也不反应;
D.四种离子之间不反应,加入盐酸后S2O32-、F-发生反应.
解答 解:A.S2-、K+、NO3-、SO42-之间不发生反应,能够大量共存,加入盐酸后S2-、NO3-之间发生氧化还原反应,不能共存,满足条件,故A正确;
B.H+、HCO3-之间发生反应,在溶液中不能大量共存,故B错误;
C.NH4+、Al3+、NO3-、Cl-之间不反应,加入盐酸后也不反应,在溶液中能够大量共存,不满足条件,故C错误;
D.Na+、K+、S2O32-、F-之间不反应,加入盐酸后S2O32-、F-发生反应,不能共存,满足条件,故D正确;
故选AD.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
12.下列变化会释放出能量的是( )
| A. | 碘升华 | B. | 酒精用于降温 | ||
| C. | 铝热反应 | D. | Ba(OH)2•8H2O和NH4Cl反应 |
10.下列有关说法正确的是( )
| A. | 标准状况下1molSO3的体积约为22.4L | |
| B. | pH小于7的雨水被称为酸雨 | |
| C. | 同温同压下,等质量的N2O4和NO2两种气体体积比为1:2 | |
| D. | 同温同压下,等质量的O2和SO2的所含原子个数比为1:1 |
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol NaHCO3与足量盐酸反应放出CO2气体的体积为22.4L | |
| B. | 1 mol Al3+离子含有的核外电子数为3NA | |
| C. | O2和O3的混合气体,质量为48g,所含氧原子数为3NA | |
| D. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2的分子数目为0.3NA |
7.下列各组数据关系中,前者比后者大的是( )
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
14.现有一硝酸钾固体样品,其中含有的杂质为可溶性的Ca(NO3)2、Mg(NO3)2、K2SO4等,通过如下几个实验步骤,可制得不含杂质的硝酸钾溶液:①加入稍过量的K2CO3溶液:②加入稍过量的KOH溶液;③加入稍过量的Ba(NO3)2溶液;④滴入稀硝酸至无气泡产生;⑤过滤,其中正确的操作顺序是( )
| A. | ③②①⑤④ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③⑤②①④ |
4.已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是( )
| A. | 水的电离程度始终增大 | |
| B. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| C. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-),c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
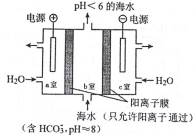 利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.
利用如图所示装置从海水中提取CO2,也有利于减少温室气体含量.
 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).