题目内容
13.下列实验装置或操作设计正确、且能达到目的是( )
| A. | 实验I:实验室制备氨气 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:电解氯化铜溶液得到铜和氯气 |
分析 A.氯化铵分解后,在试管口又化合生成氯化铵;
B.二氧化碳与NaOH反应,使烧瓶内气体减少;
C.图中缺少环形玻璃搅拌棒;
D.Cu作阳极,失去电子.
解答 解:A.氯化铵分解后,在试管口又化合生成氯化铵,不能制备氨气,应选铵盐与碱加热,故A错误;
B.二氧化碳与NaOH反应,使烧瓶内气体减少,则图在装置可作喷泉实验,故B正确;
C.图中缺少环形玻璃搅拌棒,不能准确测定最高温度,故C错误;
D.Cu作阳极,失去电子,应Cu与电源负极相连,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备、中和热测定、电解原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
4.已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是( )
| A. | 水的电离程度始终增大 | |
| B. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| C. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-),c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
18.一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表
下列说法正确的是( )
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 随pH的升高,碳钢腐蚀速率逐渐加快 | |
| B. | pH<4,发生析氢腐蚀 | |
| C. | pH为14,其负极反应为2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH为7时,负极反应为Fe_3e-═Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 |
2.短周期主族元素X、Y、Z、W的原子序数依次增大,且只有一种元素为金属元素.其中X、Z同主族.X、Y、Z的原子最外层电子数之和为15,则下列说法错误的是( )
| A. | Y、Z、W一定同周期 | B. | 简单氢化物稳定性:X>Z | ||
| C. | X、Y组成的化合物具有两性 | D. | 离子半径大小:Z>W>Y>X |
3.化学与人类的生产、生活息息相关,下列说法正确的是( )
| A. | 烟、云、雾在阳光照射下可观察到丁达尔效应 | |
| B. | “温室效应”“酸雨”的形成都与氮氧化合物有关 | |
| C. | 绿色化学的核心是对环境污染进行综合治理 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).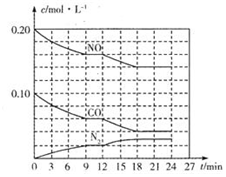 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.