题目内容
8.TiO2在工业生产和日常生活中有重要用途.I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(1)写出钛元素在周期表中的位置第四周期IVB族.
净化钛矿石时,是否需要除去杂质FeO?不需要(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:Al2O3+2OH-=2AlO2-+H2O.
(3)④中加入的X可能是A
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是除去亚铁离子.
(5)写出⑥的化学反应方程式TiOSO4+2H2O=TiO2•2H2O↓+H2SO4.
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池.
(6)阴极反应的电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti).
(7)电解过程中需定期向电解槽池中加入碳块的原因是碳单质会与阳极产生的氧气反应而不断减少.
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.因下述反应难于发生:
TiO2 (s)+2Cl2 (g)?TiCl4(1)+O2 (g)△H=+151kJ/mol
所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4.请从反应原理角度说明该反应难进行的原因该反应的△H>0,△S<0,反应难自发进行.
分析 钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2.
(1)根据其价电子数及能层数确定在元素周期表中的位置,Ti元素核外有22个电子,根据构造原理书写其基态原子核外电子排布式;氧化亚铁和硫酸反应生成硫酸亚铁,不需要除去杂质FeO;
(2)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;
(3)④X应该具有强氧化性,且不能引进杂质;
(4)④⑤两步的目的是除去亚铁离子;
(5)⑥中TiO2+水解生成TiO2•2H2O;
(6)阴极上得电子反应还原反应生成金属钛;
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳;用△H-T△S来判断反应能否发生.
解答 解:(1)Ti元素核外有22个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),该元素的能层数为4、价电子数为4,所以钛元素位于第四周期第IVB族,氧化亚铁和硫酸反应生成硫酸亚铁,所以净化钛矿石时,不需要除去杂质FeO,
故答案为:第四周期IVB族;不需要;
(2)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,所以故选A;
故答案为:A;
(4)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,
故答案为:除去亚铁离子;
(5)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO2•2H2O↓+H2SO4,
故答案为:TiOSO4+3H2O=TiO2•2H2O↓+H2SO4;
(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti),
故答案为:TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti);
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+151kJ/mol该反应中,反应物有2mol气体,生成物只有1mol气体,△S<0,又△H>0,则△H-T△S>0,故反应不能自发进行,
故答案为:碳单质会与阳极产生的氧气反应而不断减少;该反应的△H>0,△S<0,反应难自发进行.
点评 本题考查物质的分离提纯和制备,为高频考点,侧重考查学生对化学工艺流程的理解、分析、判断及对知识的综合运用能力,涉及除杂、氧化还原反应、电解原理、反应的方向判断等知识点,明确化学反应原理、元素化合物性质是解本题关键,易错点是(6)题电极反应式的书写,题目难度中等.

| A. | 元素从化合态变为游离态,该元素一定被还原 | |
| B. | 铝合金比纯铝的熔点更高 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 漂白粉应隔绝空气密封保存 |
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
| A. | Na2CO3 •H2O | B. | Na2CO3 •2H2O | C. | Na2CO3 | D. | 无法计算 |
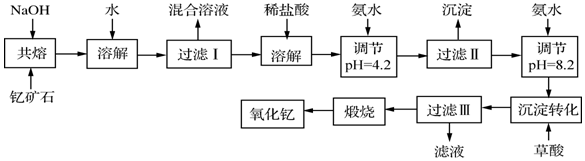
已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
请回答下列问题:
(1)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为Y2O3•FeO•2BeO•2SiO2
(2)过滤Ⅲ所得滤液的溶质主要有NH4Cl、(NH4)2C2O4(填化学式)
(3)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用bd两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
②写出Na2BeO2与足量盐酸发生反应的离子方程式BeO22-+4H+=Be2++2H2O.
(4)能否用氨水直接将溶液的pH调节至8.2,不能(填能或不能),(若不能,请说明理由)第一步用氨水是为了使Fe3+转化为沉淀而除去.
(5)写出沉淀转化步骤中沉淀转化的化学方程式2Y(OH)3+3H2C2O4═Y2(C2O4)3+6H2O.
| A. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 |
| A. | 向某溶液中先滴加氯水,再滴加KSCN溶滚,溶液显血红色,说明原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加过量氨水,先有白色沉淀产生,然后沉淀溶解,说明原溶液中含有Al3+ | |
| C. | 向某溶液中滴加Ca(OH)2溶液,得到白色沉淀,说明原溶液中含有CO32- | |
| D. | 向某溶液中滴加过量NaOH溶液,得到蓝色沉淀,说明原溶液中含有Cu2+ |
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 随pH的升高,碳钢腐蚀速率逐渐加快 | |
| B. | pH<4,发生析氢腐蚀 | |
| C. | pH为14,其负极反应为2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH为7时,负极反应为Fe_3e-═Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 |

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).