题目内容
已知:(1)Zn(s)+
O2(g)=ZnO(s)△△H=-348.3kJ/mol
(2)2Ag(s)+
O2(g)=Ag2O(s)△H=-31.0kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| 1 |
| 2 |
(2)2Ag(s)+
| 1 |
| 2 |
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| A、-317.3 kJ/mol |
| B、-379.3 kJ/mol |
| C、-332.8 kJ/mol |
| D、+317.3 kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据已知的热化学反应方程式和目标反应,利用盖斯定律来计算目标反应的反应热,以此来解答.
解答:
解:由(1)Zn(s)+
O2(g)=ZnO(s)△△H=-348.3kJ/mol,
(2)2Ag(s)+
O2(g)=Ag2O(s)△H=-31.0kJ/mol,
根据盖斯定律可知,
(1)-(2)可得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),
则△H=(-348.3kJ?mol-1)-(-31.0kJ?mol-1)=-317.3kJ?mol-1,
故选:A.
| 1 |
| 2 |
(2)2Ag(s)+
| 1 |
| 2 |
根据盖斯定律可知,
(1)-(2)可得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),
则△H=(-348.3kJ?mol-1)-(-31.0kJ?mol-1)=-317.3kJ?mol-1,
故选:A.
点评:本题考查学生利用盖斯定律计算反应的反应热,明确已知反应和目标反应的关系是解答本题的关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A、门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在 |
| B、铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高 |
| D、Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强 |
随着社会的发展,人们日益重视环境问题,下列做法或说法正确的是( )
| A、对农作物秸秆进行焚烧还田,以增加土壤肥力 |
| B、为提高农作物产量大量使用农药和化肥 |
| C、PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| D、推广使用无磷洗衣粉,以减少水体富营养化 |
下列实验过程中产生的现象与对应的图形相符的是( )
A、 NaHSO3 粉末加入HNO3溶液中 |
B、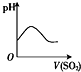 SO2气体通入新制氯水中 |
C、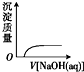 NaOH溶液滴入 Ba(HCO3)2溶液中 |
D、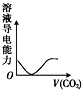 CO2气体通入澄清石灰水中 |
下列反应中必须加入还原剂才能进行的是( )
| A、FeCl3→FeCl2 |
| B、Zn→Zn2+ |
| C、H2→H2O |
| D、CuO→CuCl2 |
不需要其它试剂,只有几只试管和滴管而不能相互鉴别的物质组是( )
| A、氯化钡溶液和碳酸钠溶液 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、偏铝酸钠溶液和稀硫酸 |
| D、碳酸钠溶液和稀盐酸 |