题目内容
5.现有下列物质:①碳酸钠 ②氧化钠 ③二氧化硅 ④铁 ⑤氧气⑥氢氧化钙 ⑦硫酸 请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于单质的是④⑤,属于氧化物的是②③,属于酸的是⑦,属于碱的是⑥,属于盐的是①.
(2)写出①分别与⑥、⑦在溶液中反应的离子方程式:
Ca2++CO32-=CaCO3↓、2H++CO32-=CO2↑+H2O.
分析 (1)单质是有同种元素组成的纯净物;
酸性氧化物是和碱反应生成盐和水的氧化物;
碱性氧化物是和酸反应生成盐和水的氧化物;
酸是水溶液中电离出的阳离子全部是氢离子的化合物;
碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物;
盐是金属阳离子和酸根阴离子构成的化合物,铵盐例外;
(2)碳酸钠和氢氧化钙之间发生复分解反应产生沉淀;和硫酸之间发生复分解反应产生气体.
解答 解:①碳酸钠是盐属于纯净物;
②氧化钠和酸反应生成盐和水属于碱性氧化物,属于氧化物;
③SiO2和碱反应生成盐和水,属于酸性氧化物,是氧化物;
④铁,为单质属于纯净物;
⑤氧气属于单质是纯净物;
⑥氢氧化钙是碱属于纯净物
⑦硫酸属于酸是纯净物;
综上所述:属于单质的是④⑤,属于氧化物的是②③,属于酸的是⑦,属于碱的是⑥,属于盐的是①;
故答案为:④⑤;②③;⑦;⑥;①.
(2)碳酸钠和氢氧化钙之间发生复分解反应产生沉淀,离子方程式为:Ca2++CO32-=CaCO3↓;和硫酸之间发生复分解反应产生气体,离子方程式为:2H++CO32-=CO2↑+H2O,故答案为:Ca2++CO32-=CaCO3↓;2H++CO32-=CO2↑+H2O.
点评 本题考查了物质分类的依据和物质组成的分析判断,掌握概念是关键,题目较简单.

练习册系列答案
相关题目
15.在恒温下的密闭容器中,有可逆反应N2+3H2?2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | v正(NH3)=v逆(H2) | |
| D. | 混合气体平均相对分子质量保持不变 |
13.常用于制造飞行器外壳的金属材料是( )
| A. | 铝合金 | B. | 铁合金 | C. | 铜合金 | D. | 不锈钢 |
20.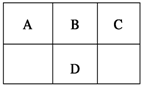 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )| A. | C可分别与A、E元素形成离子化合物 | |
| B. | D可形成三种价态的酸 | |
| C. | 原子半径:E>D>B>A>C | |
| D. | 最常见气态氢化物的稳定性:C>B>D>A |
17.某混合气体是由HF、(HF)2、(HF)3三种气体组成,该混合气体的平均相对分子质量为38,则混合气体中HF的体积分数为( )
| A. | 大于10% 小于55% | B. | 小于10% | C. | 等于10% | D. | 无法计算 |
14.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L HCl时所得的盐酸浓度不是1 mol/L,只有当22.4 L HCl溶于水制得1 L盐酸时,其浓度才是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol/L的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol/L |
15.下列说法正确的是( )
| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
 ;试剂加入顺序是先加入浓硝酸,最后加入浓硫酸,该反应需要控制温度,方法是水浴加热.
;试剂加入顺序是先加入浓硝酸,最后加入浓硫酸,该反应需要控制温度,方法是水浴加热.