题目内容
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压值:)
(1)用KSCN溶液检验出Fe3+的现象是 .
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应的方程式 .
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 性.
(4)Ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl溶液的浓度是 mol/L.
②IV中检测Cl2的实验方法: .
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应的方程式
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有
(4)Ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
②IV中检测Cl2的实验方法:
考点:电解原理
专题:电化学专题
分析:(1)依据铁离子的检验方法和试剂颜色变化分析;
(2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色;
(3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②依据检验氯气的实验方法分析.
(2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色;
(3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②依据检验氯气的实验方法分析.
解答:
解:(1)检验铁离子的试剂是硫氰酸钾溶液,用KSCN溶液检测处Fe3+的现象是溶液变红色,故答案为:溶液变为血红色;
(2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②依据检验氯气的实验方法分析,取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色证明生成氯气,否则无氯气生成,故答案为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
(2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②依据检验氯气的实验方法分析,取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色证明生成氯气,否则无氯气生成,故答案为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
点评:本题考查了离子检验方法和现象分析,电解原理的分析应用,电解反应,电极产物的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、硅胶的主要成分是硅酸钠 |
| B、明矾和氯化铁都可作净水剂 |
| C、发酵粉的主要成分是碳酸钠 |
| D、光导纤维的主要材料是晶体硅 |
某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )

| A、实验①、③反应制得的物质均为纯净物 |
| B、实验②、③均未发生氧化还原反应 |
| C、实验②、③均为放热反应 |
| D、实验①、②所涉及的物质均为电解质 |
下列事实能说明醋酸属于弱电解质的是( )
①中和10ml1mol/LCH3COOH溶液需要10ml1mol/LNaOH溶液
②物质的量溶液相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01mol/L醋酸溶液pH的大于2
④0.1mol/LCH3COONa溶液显碱性.
①中和10ml1mol/LCH3COOH溶液需要10ml1mol/LNaOH溶液
②物质的量溶液相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01mol/L醋酸溶液pH的大于2
④0.1mol/LCH3COONa溶液显碱性.
| A、①②③ | B、②③④ |
| C、①③④ | D、①④ |
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
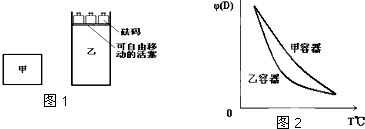

| A、甲容器中的反应先达到化学平衡状态 |
| B、两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C、两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D、在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
下列描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ?mol-1 |
| C、牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀 |
| D、用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
下列有关实验操作的说法错误的是( )
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |