题目内容
盐酸、硫酸和硝酸是中学阶段常见的三种强酸.它们的浓度不同可能会影响它们的某些化学性质.在三种酸中:
(1)常温下能用铁制容器盛装的是 (填名称,下同).
(2)检验氯离子时使用的是 酸化的硝酸银溶液;高锰酸钾溶液的氧化性与溶液的酸性有关,通常使用 来酸化;能溶解金和铂的是 的混合液.
(3)向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,已知该反应的产物只有氯化铜和水.写出其离子方程式 .
(4)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体换算成标准状况下的体积可能是 .
①6.72L ②20.16L ③30.24L ④40.32L.
(1)常温下能用铁制容器盛装的是
(2)检验氯离子时使用的是
(3)向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,已知该反应的产物只有氯化铜和水.写出其离子方程式
(4)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体换算成标准状况下的体积可能是
①6.72L ②20.16L ③30.24L ④40.32L.
考点:浓硫酸的性质,硝酸的化学性质,氯、溴、碘及其化合物的综合应用
专题:
分析:(1)常温下能用铁与浓硫酸、浓硝酸发生钝化;
(2)检验氯离子时不能引入氯离子和硫酸根,所以使用的是硝酸酸化;高锰酸钾能氧化盐酸,硝酸本身具有强氧化性,故选硫酸酸化;能溶解金和铂的是浓硝酸和浓盐酸的混合液;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸.
(4)根据铜只能和浓硫酸反应和稀硫酸不反应的性质判断;
(2)检验氯离子时不能引入氯离子和硫酸根,所以使用的是硝酸酸化;高锰酸钾能氧化盐酸,硝酸本身具有强氧化性,故选硫酸酸化;能溶解金和铂的是浓硝酸和浓盐酸的混合液;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸.
(4)根据铜只能和浓硫酸反应和稀硫酸不反应的性质判断;
解答:
解:(1)常温下能用铁与浓硫酸、浓硝酸发生钝化,所以能用铁制容器盛装的是浓硫酸、浓硝酸,故答案为:浓硫酸、浓硝酸;
(2)检验氯离子时不能引入氯离子和硫酸根,所以使用的是硝酸酸化;高锰酸钾能氧化盐酸,硝酸本身具有强氧化性,故选硫酸酸化;能溶解金和铂的是浓硝酸和浓盐酸的混合液;故答案为:(稀)硝酸;(稀)硫酸;浓硝酸和浓盐酸;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O;
故答案为:Cu+2H++H2O2=Cu2++2H2O.
(4)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O,浓硫酸的物质的量为0.1L×18mol/L=1.8mol,如被还原的硫酸是0.9mol,则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,只有①符合,故答案为:①;
(2)检验氯离子时不能引入氯离子和硫酸根,所以使用的是硝酸酸化;高锰酸钾能氧化盐酸,硝酸本身具有强氧化性,故选硫酸酸化;能溶解金和铂的是浓硝酸和浓盐酸的混合液;故答案为:(稀)硝酸;(稀)硫酸;浓硝酸和浓盐酸;
(3)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O;
故答案为:Cu+2H++H2O2=Cu2++2H2O.
(4)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)
| ||
点评:本题考查了硝酸和硫酸的性质,化学方程式的书写和判断,掌握它们的化学性质是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
硝基苯中溶有少量CaCl2,适宜的提纯方法是( )
| A、过滤 | B、蒸馏 |
| C、分液 | D、纸上层析 |
下列说法中,正确的是( )
| A、硅胶的主要成分是硅酸钠 |
| B、明矾和氯化铁都可作净水剂 |
| C、发酵粉的主要成分是碳酸钠 |
| D、光导纤维的主要材料是晶体硅 |
俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.下列不属于其中的反应的是( )
A、N2+O2
| |||
| B、2NO+O2→2NO2 | |||
| C、3NO2+H2O→2HNO3+NO | |||
D、4NH3+5O2
|
某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )

| A、实验①、③反应制得的物质均为纯净物 |
| B、实验②、③均未发生氧化还原反应 |
| C、实验②、③均为放热反应 |
| D、实验①、②所涉及的物质均为电解质 |
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
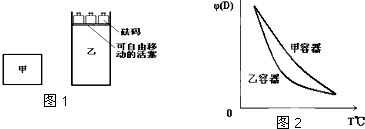

| A、甲容器中的反应先达到化学平衡状态 |
| B、两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C、两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D、在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |