题目内容
在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为 .
考点:热化学方程式,燃烧热
专题:
分析:燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1molH2完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式.
解答:
解:H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,根据H2(g)+
O2(g)═H2O(l);可知H2的物质的量为2mol,则1molH2在氧气中完全燃烧放出的热量为
×571.6kJ=285.8kJ,因此H2的燃烧热为285.8kJ/mol;H2燃烧热的热化学方程式为H2(g)+
O2(g)═H2O(l);△H=-285.8kJ?mol-1
故答案为:285.8kJ/mol,H2(g)+
O2(g)═H2O(l);△H=-285.8kJ?mol-1
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:285.8kJ/mol,H2(g)+
| 1 |
| 2 |
点评:本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式的计算应用,题目较简单.

练习册系列答案
相关题目
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求.理想的原子经济性反应是原料中的原子全部转变成所需产物,不产生副产物,实现零排放.下列几种生产乙苯( )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )A、 +C2H5Cl→ +C2H5Cl→ +HCl +HCl |
B、 +C2H5OH→ +C2H5OH→ +H2O +H2O |
C、 +CH2═CH2→ +CH2═CH2→ |
D、 → → +HBr +HBr |
观察如图,下列叙述中错误的是( )
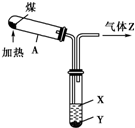

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
下列有关生产生活涉及的操作和原理说法正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
 已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)+c(OH-)=10-3mol?L-1 | ||
| B、b点所示的溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+) | ||
| C、c点的含义为:CH3COOH和NaOH恰好反应完全 | ||
D、a、b、c、d点表示的溶液中
|

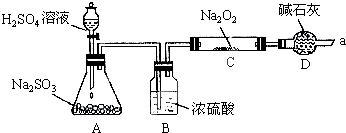
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理