题目内容
10.实验室欲配制6.00mol•L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240mL 1.00mol/L的硫酸 ②150mL 3.00mol•L-1的硫酸 ③足量的18.00mol•L-1的浓H2SO4.配制要求:①、②两种硫酸全部用完,不足部分由③补充.选用容量瓶的规格是( )| A. | 100 mL | B. | 250 mL | C. | 500 mL | D. | 1000 mL |
分析 ①、②两种硫酸全部用完,不足部分由③补充,可知所配溶液的体积大于240mL+150mL=390mL,溶质的物质的量大于0.24L×1.00mol/L+0.15L×3.00mol/L=0.69mol,答案应从C、D中选,以此解答该题.
解答 解:①、②两种硫酸全部用完,不足部分由③补充,可知所配溶液的体积大于240mL+150mL=390mL,则A、B错误;
如为500mL容量瓶,则需浓硫酸的体积最多为500mL-390mL=110mL,溶质的物质的量为0.11L×18mol/L=1.98mol,且1.98mol+0.69mol=2.67mol<6.00mol/L×0.5L;
如为1000mL,需要浓硫酸的物质的量为6.00mol/L×0.5L-0.69mol=2.31mol,体积为$\frac{2.31mol}{18mol/L}$=0.128L=128mL,且满足128mL+390mL<1000mL,可加入适量水,
故选D.
点评 本题考查物质的计算以及溶液的配制,为高频考点,侧重考查学生的分析、计算和实验能力,注意把握计算的角度以及仪器的选择,难度不大.

练习册系列答案
相关题目
7.下列溶液中有关物质的量浓度关系正确的是( )
| A. | pH=2 的HA溶液与pH=12的MOH溶液等体积混合:c(H+)=c(OH-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
4.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液加入CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
5.对处于平衡状态的反应 2A(g)+B(g)?2C(g)+Q(Q>0),下列叙述正确的是( )
| A. | 增大压强.V正增大,V逆减小 | |
| B. | 升高温度,V正减小,V逆增大 | |
| C. | 增大A浓度的瞬间,V正增大,V逆不变 | |
| D. | 增大A浓度瞬间,V正增大而V逆减小 |
19.下列实验操作正确的是( )
| A. | 粗盐提纯时,为了加快过滤速率,可以用玻璃棒进行搅拌 | |
| B. | 分液操作中,将下层液体放入烧杯中,再将上层液体继续放入另一烧杯中 | |
| C. | 测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量 | |
| D. | 蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶瓶壁 |
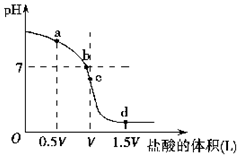 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.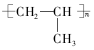 .
.