题目内容
9.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,则下列说法正确的是( )| A. | 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g | |
| B. | 充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-=PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
分析 由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应.
解答 解:由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应.
A.放电时,负极反应式为:Pb-2e-+SO42-=PbSO4,当外电路通过1mol的电子时,理论上负极板的质量增加了48g,实际上增加的是硫酸根离子的质量,故A错误;
B.充电时,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故B正确;
C.放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,电极反应式为:PbO2+2e-+SO42-=PbSO4,故C错误;
D.在充电时,铅蓄电池的正极的逆反应是氧化反应,应与充电器电源的正极相连,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,明确正负极、阴阳极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,注意原电池正负极上发生的反应为电解池阳极、阴极上发生反应的逆反应,难度中等.

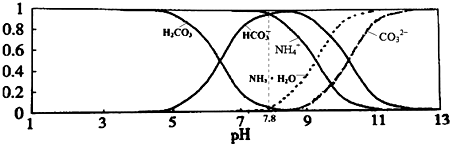
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、AlO2-、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、ClO- | D. | Na+、CH3COO-、SO42-、H+ |
| A. | Fe和Zn | B. | Mg和Al | C. | Fe、Cu、Zn | D. | Mg、Fe、Cu |
| A. | 蒸发FeCl3溶液,得到FeCl3固体 | |
| B. | 在FeCl3、CuCl2混合液中,加入少量Fe粉,一定有H2产生且有Cu析出 | |
| C. | 用FeCl3固体溶于水配制饱和溶液,会有Fe(OH)3沉淀产生 | |
| D. | 在FeCl3溶液中,加入KHCO3溶液,有CO2产生,但无Fe(OH)3沉淀生成 |
| A. | 1mol Na与乙醇完全反应,失去2NA电子 | |
| B. | 标准状况下,22.4L苯含NA个C6H6分子 | |
| C. | 0.5mol-OH和0.5mol OH-均含有5NA电子 | |
| D. | 常温常压,8gCH4含5NA个电子 |
| A. | 油脂属于高分子化合物 | B. | 糖类都能水解 | ||
| C. | 酶是一类具有催化作用的蛋白质 | D. | 淀粉和纤维素属于同分异构体 |
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.8 g Na2O2含有的阴离子数目为0.1 NA | |
| D. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA |