题目内容
1.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1mol Na与乙醇完全反应,失去2NA电子 | |
| B. | 标准状况下,22.4L苯含NA个C6H6分子 | |
| C. | 0.5mol-OH和0.5mol OH-均含有5NA电子 | |
| D. | 常温常压,8gCH4含5NA个电子 |
分析 A.Na与乙醇反应生成Na+;
B.气体摩尔体积使用对象为气体;
C.-OH含有9个电子,OH-含有10个电子;
D.依据n=$\frac{m}{M}$,结合1个甲烷分子含有10个电子解答.
解答 解:A.1mol Na与乙醇完全反应生成1mol乙醇钠,失去NA电子,故A错误;
B.标况下苯为液体,不能使用气体摩尔体积,故B错误;
C.0.5mol-OH含有4.5NA电子,0.5mol OH-均含有5NA电子,故C错误;
D.常温常压,8gCH4物质的量为$\frac{8g}{16g/mol}$=0.5mol,含有电子数为0.5mol×10×NA=5NA,故D正确;
故选:D.
点评 本题考查了有关阿伏伽德罗常数的计算,熟练掌握公式的使用和物质的结构是解题的关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 通过红外光谱分析可以区分乙醇和乙酸 | |
| B. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| D. | 石油的裂解、煤的干馏、蛋白质的盐析和淀粉的水解都是化学变化 |
9.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,则下列说法正确的是( )
| A. | 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g | |
| B. | 充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-=PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
6.下列反应的离子方程式正确的是( )
| A. | 实验室利用石灰石与稀盐酸制取CO2:CO32-+2H+=CO2↑+H2O | |
| B. | 氯气与H2O的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | Ba(OH)2溶液与稀H2SO4混合:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化钠与盐酸反应:Na2O+2H+=2Na++H2O |
13.下列7种有机物:①甲烷 ②苯 ③聚丙烯 ④2-丁炔 ⑤乙烯 ⑥邻二甲苯既能使酸性高锰酸钾褪色,又能与溴水反应褪色的是( )
| A. | ②③④⑤⑥ | B. | ③④⑤ | C. | ④⑤ | D. | ④⑤⑥ |
10.按C、N、O的顺序,下列递变规律不正确的是( )
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
(1)C的氢化物的结构式为H-S-H.
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
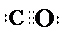 或
或 ,结构式为
,结构式为 .
. 已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):