题目内容
15.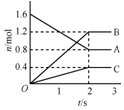 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).(2)一定温度下,将3molD气体和1molE气体通过一密闭容器中,发生如下反应:3D(g)+E(g)?xF(g).
若容器体积固定为2L,反应1min时测得剩余1.8molD,F的浓度为0.4mol/L.
①x=2;
②若反应经2min达到平衡,平衡时F的浓度小于0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,F的体积分数为25%,则D的转化率是40%.
分析 (1)根据在反应中减小的物质为反应物,增加的物质为生成物,各物质的物质的量的变化量之比等于反应中各物质的计量数之比,写出化学方程式;根据v=$\frac{△c}{△t}$计算反应速率;
(2)①根据三段式计算出1min时各组分的物质的量,设反应过程中消耗E物质的量为a,
3D(g)+E(g)?xF(g)
起始(mol) 3 1 0
变化(mol)3a a xa
1min(mol)1.8 1-a 0.8,
计算得到a和x;
②反应经2min达到平衡,反应速率小于1min时的速率,平衡时C的浓度小于1min时C的浓度的2倍;
③根据三段式计算,衡混合物中,F的体积分数为25%,设平衡状态下消耗E物质的量为b,
3D(g)+E (g)?2F(g)
起始(mol)3 1 0
变化(mol)3b b 2b
平衡(mol)3-3b 1-b 2b
计算得到b,转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:(1)由图可知,在2min时,A的物质的量减小1.6mol-0.8mol=0.8mol,A为反应物,B的物质的量增加1.2mol,C的物质的量增加0.4mol,B、C为生成物,A、B、C的物质的量的变化量之比为0.8:1.2:0.4=2:3:1,
根据反应中的计量数之比等于变化的物质的物质的量之比,要写出反应方程式为:2A?3B+C,
2s内用A的浓度变化表示的平均反应速率为$\frac{\frac{1.6mol-0.8mol}{5L}}{2s}$mol/(L•s)=0.08mol/(L•s),
故答案为:2A?3B+C;0.08mol/(L•s);
(2)①将3molD气体和1molE气体通过一密闭容器中发生如下反应:3D(g)+E(g)?xF(g).若容器体积固定为2L,反应1min时测得剩余1.8molD,F的浓度为0.4mol/L.设反应过程中消耗E物质的量为a,
3D(g)+E(g)?xF(g)
起始(mol) 3 1 0
变化(mol)3a a xa
1min(mol)1.8 1-a 0.8
3-3a=1.8,xa=0.8,
解得a=0.4,x=2,
故答案为:2;
②若反应经2min达到平衡,D、E的浓度减小,反应速率变小,反应经2min达到平衡时,平衡时F的浓度小于1min时C的浓度的2倍,即小于0.4 mol•L-1×2=0.8mol•L-1,
故答案为:小于;
③平衡混合物中,F的体积分数为25%,设平衡状态下消耗E物质的量为b,
3D(g)+E (g)?2F(g)
起始(mol)3 1 0
变化(mol)3b b 2b
平衡(mol)3-3b 1-b 2b
平衡混合物中F的体积分数为$\frac{2b}{3-3b+1-b+2b}$×100%=25%,解得b=0.4,
则D的转化率是$\frac{3b}{3}$×100%=40%,
故答案为:40%.
点评 本题主要考查了根据图象写化学方程式、计算反应速率,注意分析化学方程式的特征,根据化学平衡三段式解答,题目难度不大,注重对基础知识的考查.

| A. | C3H8只表示一种物质的分子组成 | |
| B. | C2H6的一氯代物只有1种 | |
| C. | C3H8O能与钠反应放出H2的同分异构体有3种 | |
| D. | 丙烷的二氯代物有4种 |
| A. | $\frac{Vd}{MN+2240}$ | B. | $\frac{1000Vd}{MN-2240}$ | C. | $\frac{1000VdM}{MN+2240}$ | D. | $\frac{MN}{22.4(V+0.1)d}$ |
| A. | 氨水 | B. | 蔗糖 | C. | 干冰 | D. | 碳酸 |
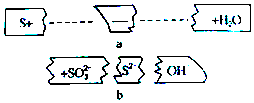
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
| A. | 己烷有4种同分异构体,一定条件下能够发生取代反应 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应属于取代反应 | |
| D. | 聚合物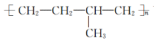 可由单体CH3CH═CH2和CH2═CH2加聚制得 可由单体CH3CH═CH2和CH2═CH2加聚制得 |
| A. | 碱金属元素随着核电荷数的增大,单质的溶沸点升高 | |
| B. | 卤族元素随着核电荷数的增大,单质的氧化性增强 | |
| C. | HF、HCl、HBr、HI的稳定性依次逐渐减弱 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐减弱 |



 +Cl2$\stackrel{一定条件}{→}$
+Cl2$\stackrel{一定条件}{→}$ +HCl.
+HCl.