题目内容
20.把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平).下列说法正确的是( )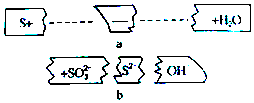
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
分析 碱性条件下,S与氢氧根离子反应生成S2-和SO32-,反应反应的离子方程式为:3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价,据此分析.
解答 解:碱性条件下,S与氢氧根离子反应生成S2-和SO32-,反应反应的离子方程式为:3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价,
A.化合价降低的硫作氧化剂,化合价升高的S作还原剂,则氧化剂与还原剂的物质的量之比为1:2,故A错误;
B.酸性条件下,不能有OH-参加或生成,故B错误;
C.反应物微粒是S、OH-,故C错误;
D.反应中3molS转移4mol电子,则2molS参加反应时,转移的电子为$\frac{2mol×4mol}{3mol}$=$\frac{8}{3}$mol,则电子数为=$\frac{8}{3}$ NA,故D正确.
故选D.
点评 本题考查了离子反应和氧化还原反应的有关计算,题目难度中等,注意把握硫及其化合物的性质,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
11.分子式为C4H8O2的有机物有多种同分异构体,其中能发生银镜反应的共有(不考虑立体异构)( )
| A. | 2种 | B. | 7种 | C. | 10种 | D. | 12种 |
8.某有机物的分子式为C4H8O2,有关其同分异构体数目的说法错误的是( )
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
5.下列有关说法正确的是( )
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
12.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图:
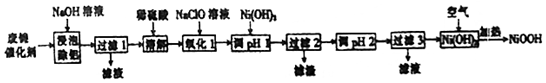
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O.
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH1“时,溶液pH范围为5.6~6.2;过滤2所得滤渣的成分为Cr(OH)2和Fe(OH)3.
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取8.29gxNiOOH•yNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010mol•L-1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4-+8H+═5Ni2++Mn2++4H2O,则x=8,y=1.

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O.
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取8.29gxNiOOH•yNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010mol•L-1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4-+8H+═5Ni2++Mn2++4H2O,则x=8,y=1.
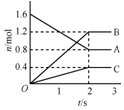 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
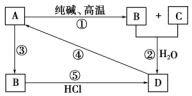 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.