题目内容
4.下列说法正确的是( )| A. | 碱金属元素随着核电荷数的增大,单质的溶沸点升高 | |
| B. | 卤族元素随着核电荷数的增大,单质的氧化性增强 | |
| C. | HF、HCl、HBr、HI的稳定性依次逐渐减弱 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐减弱 |
分析 A.碱金属元素随着核电荷数的增大,离子半径增大,金属键减小;
B.卤族元素随着核电荷数的增大,非金属性减弱;
C.非金属性越强,对应氢化物越稳定;
D.金属性越强,对应碱的碱性越强.
解答 解:A.碱金属元素随着核电荷数的增大,离子半径增大,金属键减小,则单质的溶沸点降低,故A错误;
B.卤族元素随着核电荷数的增大,非金属性减弱,则单质的氧化性减弱,故B错误;
C.非金属性越强,对应氢化物越稳定,则HF、HCl、HBr、HI的稳定性依次逐渐减弱,故C正确;
D.金属性越强,对应碱的碱性越强,则LiOH、NaOH、KOH的碱性依次逐渐增强,故D错误;
故选C.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
12.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图:
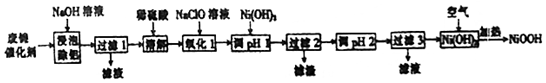
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O.
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH1“时,溶液pH范围为5.6~6.2;过滤2所得滤渣的成分为Cr(OH)2和Fe(OH)3.
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取8.29gxNiOOH•yNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010mol•L-1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4-+8H+═5Ni2++Mn2++4H2O,则x=8,y=1.

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O.
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取8.29gxNiOOH•yNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010mol•L-1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4-+8H+═5Ni2++Mn2++4H2O,则x=8,y=1.
19.下列实验合理的是( )
| A. | 用溴水除去NaCl溶液中的NaI | |
| B. | 用NaOH溶液与HCl溶液制备NaCl | |
| C. | 用NaOH溶液除去乙酸乙酯中的溴 | |
| D. | 用冷却饱和溶液法提纯含少量NaCl杂质的KNO3 |
9. 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
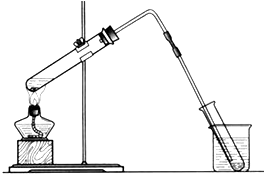
(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气兼冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
①海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
②已知KMnO4、H2O2、Cl2等均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度看I-转化成I2,最好选H2O2 (上述三种中选择)
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
①若只除去其中的不溶性杂质,应经过的实验步骤是溶解、过滤、蒸发.
②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42-是否除尽?取上层清液少许于试管中,滴加BaCl2溶液,若无白色沉淀产生,则SO42-已除尽
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-,,判断加入稀HCl适量的方法可以是向滤液中逐滴滴加稀HCl,调节溶液pH=7.
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气兼冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
①海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
②已知KMnO4、H2O2、Cl2等均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度看I-转化成I2,最好选H2O2 (上述三种中选择)
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
①若只除去其中的不溶性杂质,应经过的实验步骤是溶解、过滤、蒸发.
②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-,,判断加入稀HCl适量的方法可以是向滤液中逐滴滴加稀HCl,调节溶液pH=7.
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热为285.8 KJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
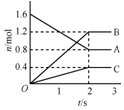 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).