题目内容
1.NA表示阿伏伽德罗常数,下列有关说法正确的是( )| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
分析 A、O2和O3均由氧原子构成;
B、氯气与水反应是可逆反应;
C、辛烷在标准状况下,是液体;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、O2和O3均由氧原子构成,故32g混合物中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,即为2NA个,故A正确;
B、氯气与水反应是可逆反应,所以22.4LCl2的物质的量为1mol,与水反应,转移电子数小于NA,故B错误;
C、辛烷在标准状况下,是液体,所以气体摩尔体积不适用,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故故1mol氯化铁形成的胶粒的个数小于NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:
由上述现象可推知c为:BaCl2(写化学式,后同),d为:Na2CO3,a与b反应的离子方程式为Ag++Cl-=AgCl↓.
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
12.将9.2g某芳香烃完全燃烧后的气体混合物通入过量的澄清石灰水中,石灰水共增重38g,然后过滤得到70g沉淀.已知该烃的相对原子质量小于100,下列说法不正确的是( )
| A. | 该烃的分子式为C7H8 | |
| B. | 该烃的含碳量大于乙烯的含碳量 | |
| C. | 该烃一氯代物有5种 | |
| D. | 该烃在光照或催化剂作用下能和氯气发生取代反应 |
9.分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
16.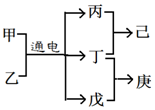 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
6.NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
13.下列物质的工业生产原理不涉及氧化还原反应的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 硫酸 | D. | 液溴 |
10.化学与生产、生活等密切相关,下列说法正确的是( )
| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
1.某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)将含1mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:HCO3-+OH-=CO32-+H2O.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水.
(5)若向含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为233g.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)将含1mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:HCO3-+OH-=CO32-+H2O.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮物净水.
(5)若向含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为233g.