题目内容
18.以NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,11.2L的水中水分子数为0.5NA | |
| B. | 通常状况下,0.5NA个氮分子占有的体积为11.2L | |
| C. | 1molH2和O2的混合气体中含2NA个分子 | |
| D. | 0.1mol的OH-中含有的电子数为NA |
分析 A、标况下水为液态;
B、通常状况下,气体摩尔体积大于22.4L/mol;
C、分子个数N=nNA;
D、氢氧根中含10个电子.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、通常状况下,气体摩尔体积大于22.4L/mol,故0.5NA个氮气分子即0.5mol氮气的体积大于11.2L,故B错误;
C、1mol氢气和氧气混合气体中的分子个数N=nNA=1mol×NA/mol=NA个,故C错误;
D、氢氧根中含10个电子,故0.1mol氢氧根中含NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
9.如图所示铜锌原电池T作时,下列叙述不正确的是( )
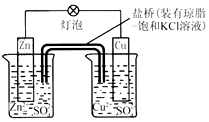

| A. | 负极反应为:2n-2e -═2n2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 盐桥中酌K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
6.下列说法中不正确的是( )
| A. | 向沸腾的蒸馏水中逐滴加入FeCl3饱和溶液,至液体呈透明的红褐色即可制得氢氧化铁胶体 | |
| B. | 观察是一种有计划、有目的地用感官考察研究对象的方法 | |
| C. | 在豆浆中加入盐卤做豆腐利用的是胶体聚沉的原理 | |
| D. | 研究物质性质的一般程序的第一步是预测物质的性质 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA | |
| B. | CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA | |
| C. | 0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA | |
| D. | 常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA |
3.同温同压下,分子数相同的CO和CO2,下列说法正确的是( )
| A. | 密度之比为7:11 | B. | 体积之比为11:7 | ||
| C. | 物质的量之比为7:11 | D. | 质量之比为11:7 |
10.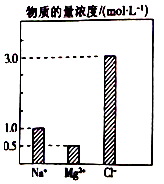 在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
 在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )| A. | NaCl的物质的量为0.2mol | |
| B. | 溶质MgCl2的质量为9 g | |
| C. | 该混合液中BaCl2的物质的量为0.1mol | |
| D. | 将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为0.1mol/L |
13.碱式硫酸铁是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝)生产碱式硫酸铁的工艺流程如下所示:
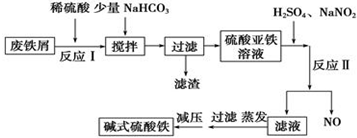
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围4.4-7.5
②写出可能发生的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂;若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)42+,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+
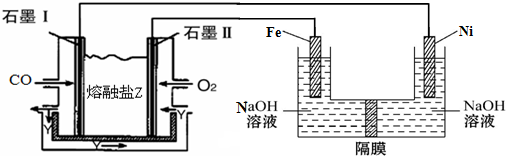
(4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式CO+CO32--2e-=2CO2
写出电解池中生成FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围4.4-7.5
②写出可能发生的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂;若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol

(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)42+,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+
(4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式CO+CO32--2e-=2CO2
写出电解池中生成FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
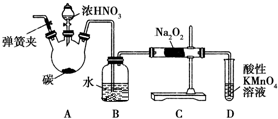 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示.已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示.已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.