题目内容
8.在一定温度下,投入4molSO2和4mol氧气,到2L的密闭容器中,反应达到平衡时n(SO2)+n(O2)=n(SO3),求二氧化硫的转化率和此温度下的平衡常数.分析 根据三段式计算出反应过程中消耗的二氧化硫、氧气及生成的三氧化硫的物质的量,然后计算出平衡时各组分的浓度,根据化学平衡常数表达式计算出该温度下的平衡常数K和二氧化硫的转化率.
解答 解:设二氧化硫的转化率为a,根据三段式:
2SO2(g)+O2 (g)?2SO3(g)
起始量4 4 0mol
转化量4a $\frac{4a}{2}$ 4a
平衡量4-4a 4-$\frac{4a}{2}$ 4a
由题,4-4a+4-$\frac{4a}{2}$=4a.解得,a=0.8=80%,
则平衡时,c(SO2)=$\frac{(4-4×0.8)mol}{2L}$=0.4mol/L,c(O2)=$\frac{(4-2×0.8)mol}{2L}$=1.2mol/L,c(SO3)=$\frac{4×0.8mol}{2L}$=1.6mol/L,
化学平衡常数K=$\frac{c^2(S{O}_{3})}{c^2(S{O}_{2})•c({O}_{2})}$=$\frac{1.6^2}{0.4^2×1.2}$=$\frac{40}{3}$,
答:二氧化硫的转化率为80%,K为$\frac{40}{3}$.
点评 本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.

练习册系列答案
相关题目
18.阿司匹林(乙酰水杨酸,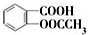 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
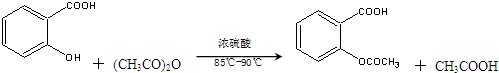
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85℃-90℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
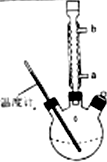
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
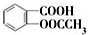 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85℃-90℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.

(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
19.用已知浓度的NaOH溶液测定未知浓度的盐酸(滴定时盐酸置于酸式滴定管中),以下操作会造成所测盐酸溶液浓度偏高的是( )
| A. | 酸式滴定管未用待测溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 锥形瓶未用待装溶液润洗 | |
| D. | 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
16.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.第2min时只改变一个条件,反应情况如表:下列说法不正确的是( )
| 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能加入了H2 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
3.下列说法正确的是( )
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
13.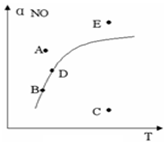 在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
 在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )| A. | A点反应未达到平衡状态,且反应正向移动 | |
| B. | C点NO转化率最低,且化学反应速率最小 | |
| C. | B、D两点均处于相应温度下的化学平衡状态,且αB(NO)<αD(NO) | |
| D. | E点反应未达平衡,反应正向移动,容器类压强增大 |
20.下列指定反应的离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
17.世博园地区改造前,规划区内有一座大型钢铁厂,附近居民曾饱受到该厂产生的棕红色烟雾的困扰.估计这一空气污染物可能含有( )
| A. | FeO粉尘 | B. | Fe3O4粉尘 | C. | Fe2O3粉尘 | D. | NO2气体 |
18.以NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L的水中水分子数为0.5NA | |
| B. | 通常状况下,0.5NA个氮分子占有的体积为11.2L | |
| C. | 1molH2和O2的混合气体中含2NA个分子 | |
| D. | 0.1mol的OH-中含有的电子数为NA |