题目内容
向NaOH溶液中通入CO2气体,充分反应后,在所得溶液中逐滴加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.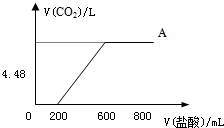
试填写下列空白:
(1)与盐酸反应前,A溶液中的溶质是 .
(2)其物质的量之比是 .

试填写下列空白:
(1)与盐酸反应前,A溶液中的溶质是
(2)其物质的量之比是
考点:有关混合物反应的计算
专题:计算题
分析:0-200mL之间没有气体产生,由于氢氧化钠与碳酸氢钠不能共存,故原溶液溶质中可能为碳酸钠或氢氧化钠、碳酸钠混合物或碳酸钠、碳酸氢钠的混合物,0-200mL之间一定发生反应:Na2CO3+HCl═NaHCO3+NaCl,200mL-600mL之间产生二氧化碳,发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,若原溶液中只有碳酸钠,由方程式可知,碳酸钠转化为碳酸氢钠消耗盐酸的体积与碳酸氢钠生成二氧化碳消耗盐酸的体积相等,而实际产生二氧化碳消耗的盐酸体积为前一阶段的2倍,故原溶液溶质为Na2CO3、NaHCO3,结合消耗盐酸的体积计算Na2CO3、NaHCO3的物质的量之比.
解答:
解:(1)0-200mL之间没有气体产生,由于氢氧化钠与碳酸氢钠不能共存,故原溶液溶质中可能为碳酸钠或氢氧化钠、碳酸钠混合物或碳酸钠、碳酸氢钠的混合物,0-200mL之间一定发生反应:Na2CO3+HCl═NaHCO3+NaCl,200mL-600mL之间产生二氧化碳,发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,若原溶液中只有碳酸钠,由方程式可知,碳酸钠转化为碳酸氢钠消耗盐酸的体积与碳酸氢钠生成二氧化碳消耗盐酸的体积相等,而实际产生二氧化碳消耗的盐酸体积为前一阶段的2倍,故原溶液溶质为Na2CO3、NaHCO3,
故答案为:Na2CO3、NaHCO3;
(2)发生反应:Na2CO3+HCl═NaHCO3+NaCl,消耗盐酸的体积为200mL,200mL-600mL之间产生二氧化碳,发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗盐酸为600mL-200mL=400mL,两反应都按物质的量之比1:1反应,故原反应中碳酸氢钠消耗盐酸的体积为400mL-200mL=200mL,原溶液中Na2CO3转化为碳酸氢钠消耗盐酸的体积与原溶液中NaHCO3转化为二氧化碳消耗盐酸的体积相等,即原溶液中Na2CO3、NaHCO3的物质的量之比=200mL:200mL=1:1,
故答案为:1:1.
故答案为:Na2CO3、NaHCO3;
(2)发生反应:Na2CO3+HCl═NaHCO3+NaCl,消耗盐酸的体积为200mL,200mL-600mL之间产生二氧化碳,发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗盐酸为600mL-200mL=400mL,两反应都按物质的量之比1:1反应,故原反应中碳酸氢钠消耗盐酸的体积为400mL-200mL=200mL,原溶液中Na2CO3转化为碳酸氢钠消耗盐酸的体积与原溶液中NaHCO3转化为二氧化碳消耗盐酸的体积相等,即原溶液中Na2CO3、NaHCO3的物质的量之比=200mL:200mL=1:1,
故答案为:1:1.
点评:本题考查混合物计算、化学反应图象有关计算,根据消耗盐酸体积判断原溶液中溶质是关键,侧重考查学生的分析思维能力,难度中等.

练习册系列答案
相关题目




 (1)在95℃时,纯水的pH
(1)在95℃时,纯水的pH