��Ŀ����
3��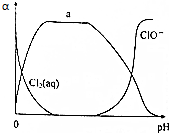 �ȼ��仯����������ˮ�������߱��ʵȷ���Ӧ�ù㷺��
�ȼ��仯����������ˮ�������߱��ʵȷ���Ӧ�ù㷺����1��д��ʵ������ȡ���������ӷ���ʽMnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+C12����
��2�����Ʊ�����ˮ�в��ֺ��ȳɷ���ռ������a����pH�仯�Ĺ�ϵ��ͼ��ʾ��
��������a����������HClO���ѧʽ����ͬ����δ��ͼ�л������Cl-��ɱ��Ч����pH�Ĺ�ϵ�ǿ�ʼ��pH���ӣ�������������һ����Χ�ڴ������״̬��������pH�����ּ�����
����֪�����������ˮ�ɱ�FeCl2��H2O2��Na2SO3�����ʻ�ԭ��Cl-��һ�ֲⶨ��ˮ����Ԫ��������ʵ�鲽�����£�
����1��ȡһ����������������������H2O2��Һ����ַ�Ӧ��
����2�����ȣ�
����3������ȴ��������������������Һ��
����4�����ˡ�ϴ�ӡ������������������
����5����ʵ�鲽��1��4�ظ�2�Σ�
��3����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2���÷�Ӧ�����ӷ���ʽΪ5ClO2-+4H+=Cl-+4ClO2��+2H2O��ClO2��Cl2��ɱ��Ч�����ã�������ʵ�����ClO2ɱ��Ч����Cl2��2.5����
���� ��1��ʵ�����ö���������Ũ�����ڼ����������Ʊ���������Ӧ�����Ȼ��̡�������ˮ��
��2����������ˮ����ƽ�⣺Cl2��aq��+H2O
����ˮ��������HClO�������ӡ�����������Ӷ����������ӣ��������������ʻ�ԭ��Cl-������������AgCl�����������ⶨ��ˮ����Ԫ��������ѡ��H2O2Ϊ��ԭ����
��3������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2����Ԫ���غ��֪��ˮ���ɣ���ƽ��д���ӷ���ʽ���ṩ����Խ�࣬����Ч��Խ�ã�����ת�Ƶ��Ӽ���ClO2ɱ��Ч����Cl2�ı�����
��� �⣺��1��ʵ�����ö���������Ũ�����ڼ����������Ʊ���������Ӧ�����Ȼ��̡�������ˮ����Ӧ���ӷ���ʽΪ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+C12����
�ʴ�Ϊ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+C12����
��2����������ˮ����ƽ�⣺Cl2��aq��+H2O
�ʴ�Ϊ��HClO��Cl-����ʼ��pH���ӣ�������������һ����Χ�ڴ������״̬��������pH�����ּ�����
����ˮ��������HClO�������ӡ�����������Ӷ����������ӣ��������������ʻ�ԭ��Cl-������������AgCl�����������ⶨ��ˮ����Ԫ���������ⶨ��ˮ����Ԫ��������ʵ�鲽�����£�
����1��ȡһ����������������������H2O2��Һ����ַ�Ӧ��
����2�����ȣ�
����3������ȴ��������������������Һ��
����4�����ˡ�ϴ�ӡ������������������
����5����ʵ�鲽��1��4�ظ�2�Σ�
�ʴ�Ϊ��H2O2����������
��3������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2����Ԫ���غ��֪��ˮ���ɣ����ӷ���ʽΪ��5ClO2-+4H+=Cl-+4ClO2��+2H2O���ṩ����Խ�࣬����Ч��Խ�ã������ʵ�����ClO2ɱ��Ч����Cl2��$\frac{5}{2}$=2.5����
�ʴ�Ϊ��5ClO2-+4H+=Cl-+4ClO2��+2H2O��2.5��
���� ���⿼��ʵ�鷽����ơ�������ԭ��Ӧ����ˮ�����ʵȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�

 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�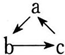 ������и��������У�����֮��ͨ��һ����Ӧ����ʵ������ͼ��ʾת�����ǣ�������
������и��������У�����֮��ͨ��һ����Ӧ����ʵ������ͼ��ʾת�����ǣ�������| ѡ�� | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HNO3 | NO | NO2 |
| C | Al��OH��3 | NaAlO2 | Al2O3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
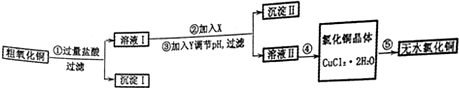
��֪��
| �������� | �������↑ʼ����ʱ��pH | �������������ȫʱ��pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
��1������ڷ�Ӧ�����ӷ���ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O��������е�����ҺpH�ķ�Χ��3.2��4.7֮�䣮
��2������жϳ�������ϴ�Ӹɾ��ķ�����ȡ���һ��ϴ��Һ�����������ữ���ٵ�����������Һ��û�а�ɫ�������ɣ�˵��ϴ�Ӹɾ�������ϴ�Ӳ��ɾ���
��3������ܵķ����Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�
��4�������Ҫ�õ���ˮ�Ȼ�ͭ����Ҫ�ڸ��ڵ�HCl�����м���CuCl2•2H2O��ԭ���Ǹ����HCl�����ȿ�����Cu2+��ˮ�⣬���ܴ���CuCl2•2H2O���Ȳ�����ˮ����
��5�����õ�ⷨ����ͭ���������ĵ缫��ӦʽΪCu2++2e-=Cu��
| A�� | FeCl3 | B�� | FeCl2 | C�� | FeS | D�� | Al��OH��3 |
| A�� | ˮ��ɱ� | B�� | �ɱ����� | C�� | ʳ������ˮ | D�� | Ũ����ϡ�� |
| A�� | KOH Na2SO4 HCl | B�� | NaHCO3 NaNO3 H2SO4 | ||
| C�� | HCl Na2CO3 NaCl | D�� | Ca��OH��2 Na2CO3 BaCl2 |

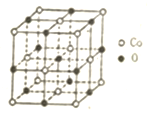 ������ȫ����һ���ɴ����������ҡ����巢��������ɣ�
������ȫ����һ���ɴ����������ҡ����巢��������ɣ�