题目内容
14.某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取氯化铜,其实验流程如下所示: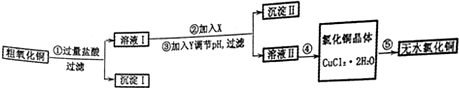
已知:
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
(1)步骤②反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.步骤③中调节溶液pH的范围是3.2~4.7之间.
(2)如何判断沉淀Ⅱ已洗涤干净的方法是取最后一次洗涤液,加入硝酸酸化,再滴入硝酸银溶液,没有白色沉淀生成,说明洗涤干净,否则洗涤不干净.
(3)步骤④的方法是加热浓缩、冷却结晶、过滤、洗涤,
(4)步骤⑤要得到无水氯化铜,需要在赶在的HCl气流中加热CuCl2•2H2O其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
(5)若用电解法精炼铜,则阴极的电极反应式为Cu2++2e-=Cu.
分析 粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II、溶液II,除去溶液中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为H2O2,然后向溶液中加入CuO等调节溶液的pH,使铁离子转化为Fe(OH)3过滤除去,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,防止氯化铜水解.
解答 解:粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II、溶液II,除去溶液中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为H2O2,然后向溶液中加入CuO等调节溶液的pH,使铁离子转化为Fe(OH)3过滤除去,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,防止氯化铜水解.
(1)步骤②是过氧化氢氧化亚铁离子为铁离子,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;步骤③是调节溶液的pH,使铁离子转化为Fe(OH)3过滤除去,当铁离子完全沉淀时溶液的pH为3.2,当铜离子出现沉淀时溶液的pH为4.7,调节溶液的pH要除去铁离子而不能除去铜离子,所以溶液的pH范围为3.2~4.7之间,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;3.2~4.7之间;
(2)沉淀Ⅱ为氢氧化铁,会附着氯离子,检验是否洗涤干净方法:取最后一次洗涤液,加入硝酸酸化,再滴入硝酸银溶液,没有白色沉淀生成,说明洗涤干净,否则洗涤不干净,
故答案为:取最后一次洗涤液,加入硝酸酸化,再滴入硝酸银溶液,没有白色沉淀生成,说明洗涤干净,否则洗涤不干净;
(3)步骤④是从溶液中获得晶体,需要经过加热浓缩、冷却结晶、过滤、洗涤得到,
故答案为:加热浓缩、冷却结晶、过滤、洗涤;
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,是为了抑制铜离子的水解,得到氯化铜晶体,同时带走产生的水蒸气;
故答案为:干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽;
(5)若用电解法精炼铜,则阴极的电极反应式为:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu.
点评 本题属于化学工业流程题目,涉及物质的分离和提纯、对操作与试剂的分析评价、电解原理应用等,关键理解工艺流程原理,是高考常考题型,较好的考查学生对知识迁移应用,题目难度中等.

称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
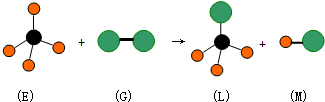
| A. | 反应过程中E中共价键断裂,G中共价键保持不动 | |
| B. | E中存在非极性键 | |
| C. | M分子有可能是HCl | |
| D. | 上述反应的类型是加成反应 |
| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| C. | 气态氢化物的稳定性:W>X | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
| A. | FeS04•7H20-绿矾 | B. | Na2O2-火碱 | C. | BaC03-重晶石 | D. | C6Hl206-庶糖 |
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 在标准状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
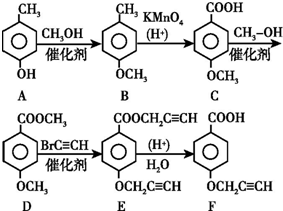
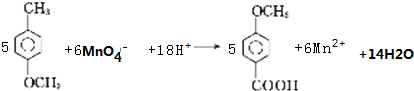 .
.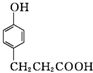 .
.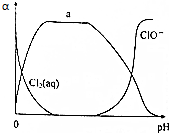 氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.
氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.