题目内容
19.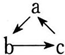 如表所列各组物质中,物质之间通过一步反应不能实现如下图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应不能实现如下图所示转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HNO3 | NO | NO2 |
| C | Al(OH)3 | NaAlO2 | Al2O3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Fe和氯气能生成FeCl3,FeCl3和Fe生成FeCl2,FeCl2和金属Zn发生置换反应生成单质铁;
B、稀HNO3和活泼金属反应生成NO,NO和氧气反应生成NO2,NO2和水反应生成HNO3;
C、Al(OH)3和NaOH反应能生成NaAlO2,NaAlO2不能一步转化为Al2O3;
D、NaOH和过量的二氧化碳反应生成NaHCO3,NaHCO3和NaOH反应生成Na2CO3,Na2CO3和Ca(OH)2反应生成NaOH.
解答 解:A、Fe和氯气能发生化合反应生成FeCl3,FeCl3和Fe发生化合反应生成FeCl2,FeCl2和金属Zn发生置换反应生成Fe和氯化锌,故A正确;
B、稀HNO3和活泼金属铁反应生成NO、硝酸铁和水,NO和氧气发生化合反应生成NO2,NO2和水反应生成NO和HNO3,故B正确;
C、Al(OH)3和NaOH反应能生成水和NaAlO2,NaAlO2不能一步转化为Al2O3,NaAlO2要转化为Al2O3至少要通过两步:NaAlO2先和过量的二氧化碳反应生成Al(OH)3和碳酸氢钠,然后Al(OH)3受热分解生成Al2O3和水,故C错误;
D、NaOH和过量的二氧化碳反应生成NaHCO3,NaHCO3和NaOH反应生成水和Na2CO3,Na2CO3和Ca(OH)2反应生成NaOH和碳酸钙沉淀,故D正确.
故选C.
点评 本题综合考查物质的性质,物质的性质及相互转化发生的反应为解答的关键,注意一步转化为解答的重点,题目难度中等.

练习册系列答案
相关题目
9.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
10.高氯酸钾广泛用于火箭及热电池等领域.实验室制取高氯酸钾的步骤为:
称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
(1)写出实验室制取高氯酸钾的化学方程式NaClO4+KCl═KClO4↓+NaCl;用蒸馏水多次洗涤晶体的目的是尽可能除去溶解度较大的杂质.
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
7.某废水中含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A. | 溶液中无法确定Al3+的存在 | |
| B. | 原溶液中不含的离子为:K+、Cu2+、CO32- | |
| C. | 步骤②中可以确定存在Cl-、Fe2+、NO3- | |
| D. | 步骤③中共有2种钡盐沉淀生成 |
14.下列有关化学实验安全问题的叙述中不正确的是( )
| A. | 浓硫酸沾到皮肤上时,可立刻用大量的水冲洗,然后再涂上3%~5%的NaHCO3溶液 | |
| B. | 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志 | |
| C. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 | |
| D. | 闻任何化学药品的气味都不能将鼻子凑近药品 |
4.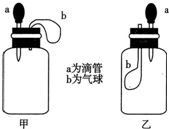 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )| A. | 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体) | |
| B. | 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气 | |
| C. | 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液 | |
| D. | 甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2 |
2.关于下列反应,说法正确的是:(图中共有三种原子)( )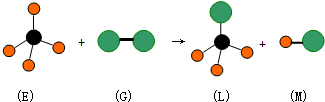

| A. | 反应过程中E中共价键断裂,G中共价键保持不动 | |
| B. | E中存在非极性键 | |
| C. | M分子有可能是HCl | |
| D. | 上述反应的类型是加成反应 |
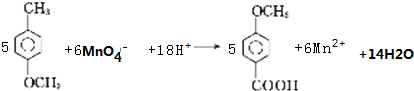 .
.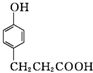 .
.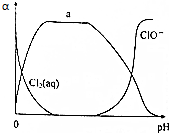 氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.
氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.