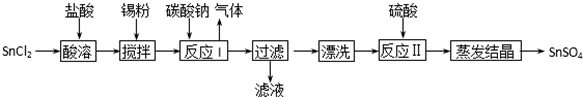
题目内容
18.某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O他们设计如图1所示装置制取氯气并验证其性质.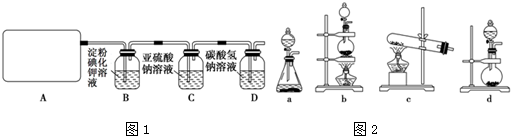
试回答:
(1)该实验中A部分的装置如图2是b(填写装置的序号).
(2)A中发生反应一段时间后,B中的现象是溶液变成蓝色,B中发生反应的化学方程式为2KI+Cl2═2KCl+I2.该实验存在的明显缺陷为无尾气吸收.
(3)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤)取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化.
分析 (1)根据反应物的状态及反应条件选择气体的发生装置;
(2)氯气具有强的氧化性,与碘化钾反应生成单质碘和氯化钾,单质碘遇淀粉变蓝;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;
(3)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化.
解答 解:(1)从方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置,
故答案为:b;
(2)氯气具有强的氧化性,碘化钾反应2KI+Cl2═2KCl+I2,生成的I2遇到淀粉变蓝色;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;
故答案为:溶液变成蓝色;2KI+Cl2═2KCl+I2;无尾气吸收;
(3)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,检验硫酸根离子的存在选用试剂稀盐酸和氯化钡溶液,实验设计如下:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化;
故答案为:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化.
点评 本题考查氯气的实验室制备、氯气的性质、实验的设计,硫酸根离子的检验注意排除其他离子的干扰,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
2.下列物质:①干燥的氯气 ②过氧化钠粉末 ③漂白粉④活性炭,其中能使红墨水褪色的是( )
| A. | ①④ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
6.下列说法不正确的是( )
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
13.蒸馏水的制取及检验
| 实验目的 | 实验操作 | 现象 | 结论 |
| 自来水中离子检验 | 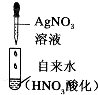 | 出现不溶于稀HNO3的沉淀 | 自来水中含氯离子 |
| 水的提纯 | 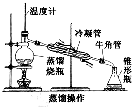 | 蒸馏烧瓶中水沸腾,冷凝管中有无色液体凝结,并通过冷凝管流入锥形瓶中 | 锥形瓶中收集到无色液体 |
| 蒸馏水中杂质离子的检验 | 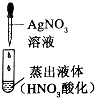 | 无明显现象 | 蒸馏水中不含氯离子 |
3.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
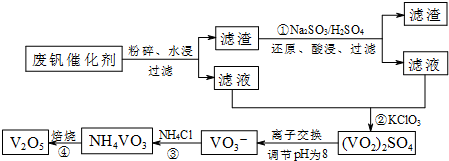
部分含钒物质在水中的溶解性如下:
(1)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据如图判断最佳控制氯化铵系数和温度为4和80℃.

(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□2H+=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+ $?_{充电}^{放电}$VO2++H2O+V3+,电池放电时正极的电极反应式为VO2++2H++e-═VO2++H2O.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据如图判断最佳控制氯化铵系数和温度为4和80℃.

(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□2H+=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+ $?_{充电}^{放电}$VO2++H2O+V3+,电池放电时正极的电极反应式为VO2++2H++e-═VO2++H2O.