题目内容
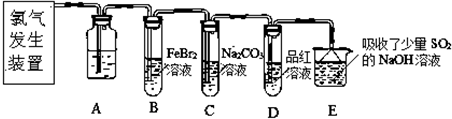
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: .
(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-394kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-572kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2600kJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H= .
(3)4.6g酒精和一定量的氧气混合点燃,恰好完全燃烧,生成5.4g水和4.48L CO2(产物均在标准状况下测定),并放出140kJ热量,写出表示酒精燃烧热的热化学方程式为: .
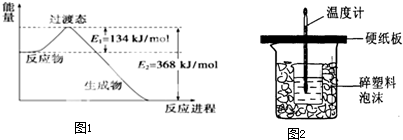
(4)中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图2所示的装置中进行中和反应.请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是 ,烧杯间填满碎塑料泡沫的作用是 .
②大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小’、“无影响”)
③实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),理由是 ,所求中和热的数值会 (填“相等”或“不相等”).

(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-394kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-572kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2600kJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=
(3)4.6g酒精和一定量的氧气混合点燃,恰好完全燃烧,生成5.4g水和4.48L CO2(产物均在标准状况下测定),并放出140kJ热量,写出表示酒精燃烧热的热化学方程式为:
(4)中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图2所示的装置中进行中和反应.请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是
②大烧杯上如不盖硬纸板,则求得的中和热数值
③实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量
考点:热化学方程式,用盖斯定律进行有关反应热的计算,中和热的测定
专题:化学反应中的能量变化
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,根据热化学方程式书写原则进行书写;
(2)根据盖斯定律计算反应的焓变;
(3)根据热化学方程式的意义以及系数和焓变的关系结合热化学方程式的书写知识来回答;
(4)①根据量热计的构造来判断该装置的缺少仪器,中和热测定实验成败的关键是保温工作;
②大烧杯上如不盖硬纸板,会使一部分热量散失;
③反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
(2)根据盖斯定律计算反应的焓变;
(3)根据热化学方程式的意义以及系数和焓变的关系结合热化学方程式的书写知识来回答;
(4)①根据量热计的构造来判断该装置的缺少仪器,中和热测定实验成败的关键是保温工作;
②大烧杯上如不盖硬纸板,会使一部分热量散失;
③反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(2)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ?mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ?mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×
-③×
得到,
所以反应焓变△H=2×(-393.5kJ?mol-1)+(-571.6kJ?mol-1)×
-(-2599kJ?mol-1)×
=+226.7kJ?mol-1,
故答案为:+226.7kJ?mol-1;
(3)4.6g即0.1mol酒精完全燃烧,生成5.4g即0.3mol水和4.48L 即0.2molCO2(产物均在标准状况下测定),并放出140kJ热量,则CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1400kJ/mol,故答案为:CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1400kJ/mol,;
(4)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:环形玻璃搅拌器;隔热,防止热量散失;
②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
③反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;放出的热量与参与反应的物质的多少有关,所用物质越多,放出热量越多;相等.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(2)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ?mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ?mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×
| 1 |
| 2 |
| 1 |
| 2 |
所以反应焓变△H=2×(-393.5kJ?mol-1)+(-571.6kJ?mol-1)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+226.7kJ?mol-1;
(3)4.6g即0.1mol酒精完全燃烧,生成5.4g即0.3mol水和4.48L 即0.2molCO2(产物均在标准状况下测定),并放出140kJ热量,则CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1400kJ/mol,故答案为:CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1400kJ/mol,;
(4)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:环形玻璃搅拌器;隔热,防止热量散失;
②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
③反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;放出的热量与参与反应的物质的多少有关,所用物质越多,放出热量越多;相等.
点评:本题考查了热化学方程式的书写、盖斯定律的应用、有关中和热的测定等方面知识,注意中和热与酸、碱的物质的量无关,难度不大.

练习册系列答案
相关题目
下列有关说法正确的是( )
①进行中和热的测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
②用滴定管量取盐酸前,先用蒸馏水洗净后再用待取盐酸进行润洗
③用蒸馏装置可以制乙酸乙酯,但温度计的水银球应放入液体中
④蔗糖水解实验,用NaOH中和稀硫酸之后再用新制的氢氧化铜检验是否水解.
①进行中和热的测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
②用滴定管量取盐酸前,先用蒸馏水洗净后再用待取盐酸进行润洗
③用蒸馏装置可以制乙酸乙酯,但温度计的水银球应放入液体中
④蔗糖水解实验,用NaOH中和稀硫酸之后再用新制的氢氧化铜检验是否水解.
| A、②③ | B、①③ | C、①②④ | D、①② |
下列物质中,形成的化学键是离子键的是( )
| A、KCl |
| B、NH3 |
| C、CO2 |
| D、C12 |
下列化学实验事实及解释都正确的是( )
| A、碳酸钙不溶于水,所以它是非电解质 |
| B、强电解质的水溶液一定比弱电解质溶液的导电能力强 |
| C、升高温度可以增大单位体积内活化分子的百分数 |
| D、非自发反应在任何条件下都不能实现 |
下列离子方程式书写错误的是( )
| A、向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ |
| B、碳酸钙与盐酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、氧化铜与稀硫酸:CuO+2H+═Cu2++H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |