题目内容
在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度0.2mol/L,加入等体积的0.2mol/L KOH溶液(混合后溶液体积变化忽略不计),使反应生成的白色沉淀恰好完全溶解,则最后混合溶液中,钾离子约为多少mol/L?为什么?
考点:化学方程式的有关计算
专题:计算题
分析:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液;加入与SO42-等体积、等浓度的KOH溶液时,生成的沉淀恰好完全溶解,发生总反应为:Al3++4OH-=AlO2-+2H2O,根据方程式可知,原溶液中c(Al3+)=
c(OH-),根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42),据此计算原溶液中K+离子的浓度,溶液中钾离子包括KOH含有的与原溶液中的钾离子,设溶液体积都是1L,根据n=cV计算混合后溶液中n(K+),进而计算混合后K+的浓度.
| 1 |
| 4 |
解答:
解:加入与SO42-等体积、等浓度的KOH溶液时,生成的沉淀恰好完全溶解,发生反应为:Al3++4OH-=AlO2-+2H2O,
根据方程式可知,铝离子的物质的量为:n(Al3+)=
n(OH-),
所以原溶液中:c(Al3+)=
c(OH-)=
×0.2mol/L=0.05mol/L,
根据溶液呈电中性可知,原混合溶液中:3c(Al3+)+c(K+)=2c(SO42-),
所以原溶液中:c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,
设合溶液与氢氧化钾溶液的体积都是1L,则混合后溶液中n(K+)=1L×(0.25mol/L+0.2mol/L)=0.45mol,
所以反应后的溶液中K+的浓度为c(K+)=
=0.225mol/L,
答:最后混合溶液中,钾离子物质的量浓度为0.225mol/L.
根据方程式可知,铝离子的物质的量为:n(Al3+)=
| 1 |
| 4 |
所以原溶液中:c(Al3+)=
| 1 |
| 4 |
| 1 |
| 4 |
根据溶液呈电中性可知,原混合溶液中:3c(Al3+)+c(K+)=2c(SO42-),
所以原溶液中:c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,
设合溶液与氢氧化钾溶液的体积都是1L,则混合后溶液中n(K+)=1L×(0.25mol/L+0.2mol/L)=0.45mol,
所以反应后的溶液中K+的浓度为c(K+)=
| 0.45mol |
| 1L+1L |
答:最后混合溶液中,钾离子物质的量浓度为0.225mol/L.
点评:本题考查了有关混合物的计算,题目难度中等,根据电荷守恒计算原混合溶液中钾离子浓度是关键,注意掌握有关混合物反应的计算方法与技巧.

练习册系列答案
相关题目
 常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )| A、图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- |
| B、当V[NaOH(aq)]=20mL时,溶液中由水电离出的c(OH-)大于10-7 mol?L-1 |
| C、当V[NaOH(aq)]=40 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干后停止加热 |
| D、可以用四氯化碳萃取碘水中的碘单质 |

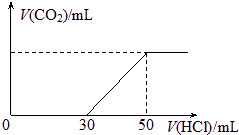 标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求:
标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求: