题目内容
在标准状况下,测得1.32g某气体的体积为0.672L.则此气体的摩尔质量为 .
考点:摩尔质量
专题:计算题
分析:根据n=
计算气体的物质的量,再根据M=
计算该气体的摩尔质量.
| V |
| Vm |
| m |
| n |
解答:
解:在标准状况下1.32克某气体的体积为0.672L,
该气体物质的量为
=0.03mol,
故该气体摩尔质量为
=44g/mol,
答:该气体的摩尔质量为44g/mol.
该气体物质的量为
| 0.672L |
| 22.4L/mol |
故该气体摩尔质量为
| 1.32g |
| 0.03mol |
答:该气体的摩尔质量为44g/mol.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用,侧重对基础知识的巩固.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
将钠投入下列溶液中,反应的剧烈程度由强到弱的是( )
①NaCl溶液
②NaOH溶液
③0.1mol?L-1盐酸
④0.1mol?L-1FeCl2溶液
⑤C2H5OH.
①NaCl溶液
②NaOH溶液
③0.1mol?L-1盐酸
④0.1mol?L-1FeCl2溶液
⑤C2H5OH.
| A、①②③④⑤ |
| B、④③①②⑤ |
| C、③④①②⑤ |
| D、⑤①③④② |
下列有关物质的量的说法中,正确的是( )
| A、Mg的摩尔质量为24g |
| B、物质的量的单位是摩尔 |
| C、1 mol O2在任何条件下的体积都为22.4L |
| D、将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1 mol?L-1 |
下列有关说法正确的是( )
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |
向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示.乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.则下列说法不正确的是( )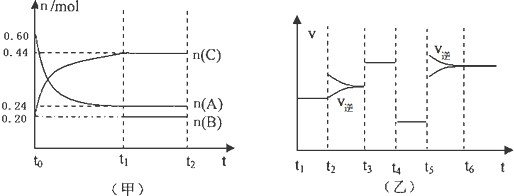

| A、若t1=15s,则t0-t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L?s) |
| B、B的起始物质的量为0.08mol |
| C、若t2-t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变大 |
| D、该反应为放热反应 |