题目内容
14.下表是元素周期表中的一部分:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)A分别与D、E、F、G、H形成的化合物中显碱性的是NH3,最稳定的是HF.
(3)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(4)B、C、H三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为S,I为Ne,然后利用元素及其单质、化合物的性质来解答.
解答 解:(1)表中元素,化学性质最不活泼的是I为Ne,只有负价而无正价的是G为F,氧化性最强的单质是非金属性最强的氟气,还原性最强的单质是金属性最强的钠,故答案为:Ne;F;F2;Na;
(2)H分别与C、N、P、F、S形成的化合物中显碱性的是NH3,最稳定的是非金属性最强的氟,形成的HF,故答案为:NH3;HF;
(3)在Na、Al,C,N,P,F,S中,电子层越多半径越大,电子层相同,核电核数越多半径越小,所以原子半径最大的是第三周期的Na,故答案为:Na;
(4)Na、Al、S三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
点评 本题考查元素周期表和元素周期律,明确元素在周期表中的位置是解答本题的关键,然后利用单质、化合物的性质来解答即可,难度不大.

练习册系列答案
相关题目
5.某无色混合气体,可能含有CO、H2、SO2、Cl2、HCl中的一种或几种,把此混合气体通过NaOH溶液,无明显现象;再通过红热的CuO粉末,粉末变成红色;最后通入AgNO3溶液中,无沉淀生成,则下列关于此混合气体的叙述正确的是( )
| A. | CO和H2中至少有一种 | B. | 肯定没有Cl2和HCl | ||
| C. | 肯定有SO2 | D. | 不能确定有无Cl2、HCl、SO2 |
2.关于铅蓄电池Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O的说法不正确的是( )
| A. | 放电时,正极发生的反应是Pb+SO42-+2e-═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变小 | |
| D. | 放电时,每当消耗1 mol铅时转移电子2 mol |
9.下列有关化学用语正确的是( )
| A. | CO2的电子式: | B. | Cl-的结构示意图: | ||
| C. | HCl的结构式: | D. | 质量数为37的氯原子:17 37Cl |
6.下列电子式书写正确的有( )
| A. | 氮分子  | B. | 过氧化氢  | C. | Na2O  | D. | 氯气 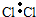 |
3.下列物质中不含非极性共价键的是( )
①Na2O2 ②CH4 ③FeS2 ④NH4Cl ⑤H-O-O-H ⑥Ca(OH)2.
①Na2O2 ②CH4 ③FeS2 ④NH4Cl ⑤H-O-O-H ⑥Ca(OH)2.
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
4.图是元素周期表的一部分,其中A、B、C为短周期主族元素,下列说法正确的是( )
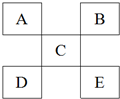

| A. | 如果D是金属元素,那么D元素的金属性比C强 | |
| B. | 元素C的最高价氧化物对应的水化物一定是强酸 | |
| C. | 元素B与氢形成的化合物中只能存在极性共价键 | |
| D. | 若E为非金属,则E的非金属性要强于B |
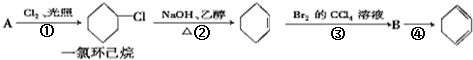
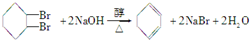 .
.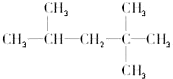 现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:
现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图: