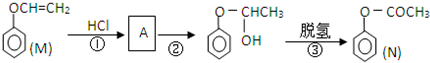
题目内容
已知X为Fe2O3和CuO的混合物,且知氧化性顺序:Fe3+>Cu2+>H+>Fe2+.取X样品进行如图所示的实验
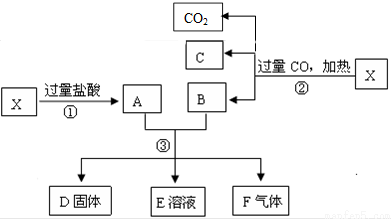
(1)写出③步可能发生反应的离子方程式为 .(共有3个)
(2)若溶液E中只有一种金属离子,则一定是 ;若溶液E含有两种金属离子,则一定是 .
(3)若D固体是纯净物,该固体是 .(填化学式)
(4)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为 .

(1)写出③步可能发生反应的离子方程式为
(2)若溶液E中只有一种金属离子,则一定是
(3)若D固体是纯净物,该固体是
(4)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为
考点:无机物的推断
专题:推断题
分析:(1)X为Fe2O3和CuO的混合物,与盐酸反应生成的A中含有氯化铁和氯化铜,被一氧化碳还原后生成的B中含有铜和铁的单质,根据氧化强弱可写离子方程式;
(2)根据阳离子的氧化强弱可知,溶液中一定有氧化最弱的阳离子;
(3)X与过量CO反应生成固体B为铁和铜的混合物,溶液A中含有氯化铁、氯化铜,则D可能为铜,也有可能为铁与铜的混合物,据此答题;
(4)根据氧化还原反应中氧化剂的氧化性强于氧化产物,可写离子反应方程式;
(2)根据阳离子的氧化强弱可知,溶液中一定有氧化最弱的阳离子;
(3)X与过量CO反应生成固体B为铁和铜的混合物,溶液A中含有氯化铁、氯化铜,则D可能为铜,也有可能为铁与铜的混合物,据此答题;
(4)根据氧化还原反应中氧化剂的氧化性强于氧化产物,可写离子反应方程式;
解答:
解:(1)X为Fe2O3和CuO的混合物,与盐酸反应生成的A中含有氯化铁和氯化铜,被一氧化碳还原后生成的B中含有铜和铁的单质,由于氧化性Fe3+>Cu2+>H+>Fe2+,所以溶液中可能发生的离子反应有:Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+、2Fe3++Cu=Cu2++2Fe2+,
故答案为:Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+、2Fe3++Cu=Cu2++2Fe2+;
(2)根据(1)中发生的离子反应可知,溶液中一定有Fe2+,如果铁单质较少,Fe3+较多,则铜可以被氧化成Cu2+,此时溶液中有Cu2+和Fe2+,
故答案为:Fe2+;Cu2+和Fe2+;
(3)由于铜是不活泼金属,Fe3+首先氧化Fe,所以D固体如果是纯净物,则一定是Cu,
故答案为:Cu;
(4)根据氧化强弱可知,Fe3+可以氧化Cu,生成Cu2+,离子反应方程式为2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Fe3++Cu=Cu2++2Fe2+;
故答案为:Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+、2Fe3++Cu=Cu2++2Fe2+;
(2)根据(1)中发生的离子反应可知,溶液中一定有Fe2+,如果铁单质较少,Fe3+较多,则铜可以被氧化成Cu2+,此时溶液中有Cu2+和Fe2+,
故答案为:Fe2+;Cu2+和Fe2+;
(3)由于铜是不活泼金属,Fe3+首先氧化Fe,所以D固体如果是纯净物,则一定是Cu,
故答案为:Cu;
(4)根据氧化强弱可知,Fe3+可以氧化Cu,生成Cu2+,离子反应方程式为2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Fe3++Cu=Cu2++2Fe2+;
点评:本题主要考查常见金属单质及其化合物的性质,难度不大,解题时注意氧化还原反应原理的灵活运用,以及化学用语的规范表达.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
下列物质中,导电性能最差的是( )
| A、石墨棒 |
| B、HCl溶液 |
| C、熔融的氢氧化钾 |
| D、固体氯化钾 |
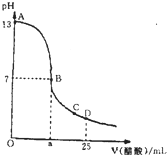 室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )
室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、在B点时:a=12.5 |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)=c(CH3COOH) |

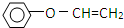 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: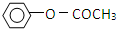 )的流程如下(条件略)
)的流程如下(条件略)