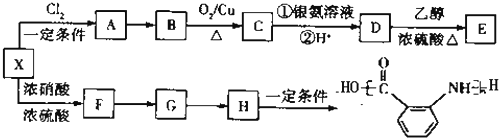
题目内容
如图是某硫酸试剂瓶标签上的部分文字.据此,下列说法正确的是( )


| A、该硫酸的物质的量浓度为9.2mol?L-1 |
| B、1 mol Zn与足量的该硫酸反应生成2g氢气 |
| C、该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol?L-1 |
| D、向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol |
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:
分析:A.根据c=
计算出该硫酸的物质的量浓度;
B.该硫酸溶液为浓硫酸,与锌反应生成二氧化硫气体;
C.该硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍;
D.随着反应进行,浓硫酸变为稀硫酸,金属铜和稀硫酸不反应.
| 1000ρω |
| M |
B.该硫酸溶液为浓硫酸,与锌反应生成二氧化硫气体;
C.该硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍;
D.随着反应进行,浓硫酸变为稀硫酸,金属铜和稀硫酸不反应.
解答:
解:A.该硫酸的物质的量浓度为:c=
mol/L=18.4mol/L,故A错误;
B.该硫酸是浓硫酸,浓硫酸与锌反应生成二氧化硫气体,不会生成氢气,故B错误;
C.硫酸与等体积水混合后,所得溶液中硫酸的物质的量不变,则稀释前后,硫酸的物质的量不变,c1V1=c2V2,所以c2=
=
,但是V2<2V1,故所得溶液的物质的量浓度大于9.2mol/L,故C错误;
D.金属铜和稀硫酸不反应,随着反应进行,浓硫酸变为稀硫酸,不会反应放出二氧化硫,故被还原的硫酸的物质的量小于0.46mol,故D正确;
故选D.
| 1000×1.84×98% |
| 98 |
B.该硫酸是浓硫酸,浓硫酸与锌反应生成二氧化硫气体,不会生成氢气,故B错误;
C.硫酸与等体积水混合后,所得溶液中硫酸的物质的量不变,则稀释前后,硫酸的物质的量不变,c1V1=c2V2,所以c2=
| c1V1 |
| V2 |
| 18.4V1 |
| V2 |
D.金属铜和稀硫酸不反应,随着反应进行,浓硫酸变为稀硫酸,不会反应放出二氧化硫,故被还原的硫酸的物质的量小于0.46mol,故D正确;
故选D.
点评:本题考查物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确物质的量浓度与溶质质量分数的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
下列措施不能加快锌与稀H2SO4反应速率的是( )
| A、加入少量CuSO4固体 |
| B、将Zn粒改为Zn粉 |
| C、增大压强 |
| D、加热 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,48gO3与O2混合气体中含氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、11.2L氧气中所含有的原子数为NA |
| D、标准状况下,22.4 LC6H14中所含碳原子数为6NA |
关于“摩尔”叙述正确的是( )
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
| C、摩尔是物质的量的单位,简称摩,符号为mol |
| D、国际上规定,0.012kg碳原子所含有的碳原子数目为1摩尔 |
“纳米技术”广泛地应用于催化及军事科学中,“纳米材料”是指粒子直径在几纳米到几十纳米(nm)之间的材料(1nm=10-9m).如将纳米材料分散到液体分散剂中,所得混合物具有的性质是( )
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |
下列物质中属于混合物的是( )
①五水硫酸铜 ②液氧 ③干冰 ④稀盐酸 ⑤氢氧化铁胶体 ⑥乙醇⑦洁净的矿泉水.
①五水硫酸铜 ②液氧 ③干冰 ④稀盐酸 ⑤氢氧化铁胶体 ⑥乙醇⑦洁净的矿泉水.
| A、①②⑤⑦ | B、④⑤⑦ |
| C、③④⑥ | D、⑤⑥⑦ |
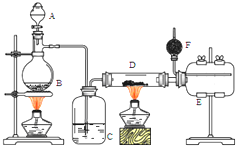 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空: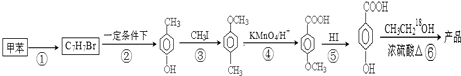
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
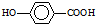
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有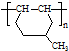 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图: