题目内容
20.在标准状况下,14.4gCO和CO2混合气体的体积为8.96L.求:(1)混合气体的平均相对分子质量?
(2)两种气体混合前的质量和体积各是多少?
(3)混合气体中碳、氧原子的质量比是多少?
分析 混合气体的体积为8.96L,则物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据气体的总质量和总物质的量列方程式计算.
解答 解:混合气体的体积为8.96L,则物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,混合气体的平均摩尔质量为:$\frac{14.4g}{0.4mol}$=36g/mol,
设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则28x+44y=12.8,x+y=0.4,
解得x=0.3mol,y=0.1mol
所以m(CO)=0.3mol×28g/mol=8.4g,m(CO2)=4.4g,
标况下一氧化碳和二氧化碳体积为22.4L/mol×0.3mol=6.72L,22.4L/mol×0.1mol=2.24L,混合气体中碳、氧原子的质量比是(0.3+0.1)×12:(0.3+0.1×2)×16=3:5,
答:(1)混合气体的平均相对分子质量为36;
(2)两种气体混合前的质量m(CO)=8.4g,m(CO2)=4.4g,体积各是6.72L、2.24L;
(3)混合气体中碳、氧原子的质量比是3:5.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用,注意平均相对分子量的求法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,C12 可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙二酸可与高锰酸钾溶液发生反应 | |
| C. | 乙醇和乙烯的混合物 lmol,完全燃烧消耗 3molO2 | |
| D. | 光照下 2,2-二甲基丁烷与 Br2 反应,其一溴取代物只有 2 种 |
11.相对原子质量为X的原子的实际质量为( )
| A. | X | B. | Xg | C. | $\frac{X}{{N}_{A}}$g | D. | $\frac{1}{{N}_{A}}$g |
8.下列叙述中不正确的是( )
| A. | 向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体 | |
| B. | 用纯碱溶液清洗油污时,加热可以增强其去污能力 | |
| C. | 向纯水中加入稀硫酸或降温都能使水的离子积减小 | |
| D. | 锅炉中沉积的CaSO4可用足量Na2CO3溶液浸泡后,再用稀盐酸溶解掉不溶物 |
5.某学生为测定生石膏的组成(CaSO4•xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前后都称量固体质量.随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如表:
另外,某老师通过实验证明了第7次实验得到的2.72g剩余固体中只含有CaSO4.
(1)利用实验数据,通过计算推断生石膏的化学式为CaSO4•2H2O
(2)CaSO4的摩尔质量是136/mol
(3)第3次实验时CaSO4•xH2O分解得到0.01mol熟石膏,假设熟石膏的化学式是aCaSO4•bH2O,且a和b都是正整数,则a=2,b=1.
| 实验顺序 | 加热前/g | 加热后/g |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
(1)利用实验数据,通过计算推断生石膏的化学式为CaSO4•2H2O
(2)CaSO4的摩尔质量是136/mol
(3)第3次实验时CaSO4•xH2O分解得到0.01mol熟石膏,假设熟石膏的化学式是aCaSO4•bH2O,且a和b都是正整数,则a=2,b=1.
12.在高压下将CO2可以转化为具有类似SiO2结构的原子晶体.下列关于CO2的原子晶体说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
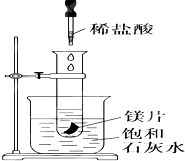 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: