题目内容
18.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.01mol•L-1、0.03mol•L-1、0.08mol•L-1,则下列判断正确的是( )| A. | C1:C2=3:1 | |
| B. | C2的取值范围为0 mol•L-1<C2<0.15 mol•L-1 | |
| C. | X、Y的转化率不相等 | |
| D. | C1的取值范围为0 mol•L-1<C1<0.15 mol•L-1 |
分析 X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.01mol•L-1、0.03mol•L-1、0.08mol•L-1,利用极值转化;
A.可根据反应转化关系和平衡浓度计算初始浓度关系;
B.根据可逆不能完全转化的角度分析;
C.起始量相同,平衡量相同,转化率相同;
D.根据可逆不能完全转化的角度分析.
解答 解:A.设X转化的浓度为x,
X(g)+3Y(g)?2Z(g)
初始:c1 c2 c3
转化:x 3x 2x
平衡:0.01moL/L 0.03mol/L 0.08mol/L
所以c1:c2=(x+0.01moL/L):(3x+0.03mol/L)=1:3,故A错误;
B.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则c2>0,如反应向逆反应分析进行,0.08mol•L-1Z完全分解产生Y为$\frac{0.08×3}{2}$=0.12mol•L-1,则c2<(0.03+0.12)mol•L-1,故有0<c2<0.15mol•L-1故B正确;
C.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故C错误;
D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则c1>0,如反应向逆反应分析进行,0.08mol•L-1Z完全分解产生X为0.04mol•L-1,则c1<(0.01+0.04)mol•L-1,故有0<c1<0.05mol•L-1,故D错误;
故选B.
点评 本题考查化学平衡的计算,题目难度不大,本题注意化学平衡状态的判断方法以及可逆反应的特点.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
11.相对原子质量为X的原子的实际质量为( )
| A. | X | B. | Xg | C. | $\frac{X}{{N}_{A}}$g | D. | $\frac{1}{{N}_{A}}$g |
12.在高压下将CO2可以转化为具有类似SiO2结构的原子晶体.下列关于CO2的原子晶体说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
13.胶体在人们的日常生活中随处可见.下列分散系属于胶体的是( )
| A. | 泥水 | B. | 豆浆 | C. | 生理盐水 | D. | 油水双合物 |
3.按下图所示装置,放置一段时间后,溶液的pH下降的是( )
| A. |  | B. |  | C. |  | D. |  |
10.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热NaCl使之融化 | D. | 氢气在氯气中燃烧 |
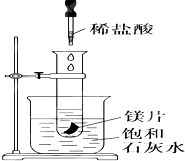 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: