题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: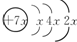 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)A为 ,电子排布式是 ;
(2)B的符号为 ;
(3)C的价电子排布式是 ;
(4)D为 ,价电子轨道表示式是 ;
(5)E的原子结构示意图是 .
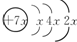 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)A为
(2)B的符号为
(3)C的价电子排布式是
(4)D为
(5)E的原子结构示意图是
考点:原子结构与元素周期律的关系
专题:
分析:A、B、C、D是四种短周期元素,A的原子结构示意图为: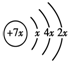 ,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,据此解答.
,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,据此解答.
 ,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,据此解答.
,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,据此解答.解答:
解:A、B、C、D是四种短周期元素,A的原子结构示意图为: ,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,
,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,
(1)A为Si元素,原子核外电子数为14,基态原子的电子排布式是:1s22s22p63s23p2,故答案为:Si;1s22s22p63s23p2;
(2)B为Na元素,故答案为:Na;
(3)C为P元素,最外层有三个成单电子,价电子排布为3s23p3,故答案为:3s23p3;
(4)D为N元素,原子核外电子数为7,价电子排布为2s22p3,价电子轨道表示为: ,故答案为:N;
,故答案为:N; ;
;
(5)F为Fe元素,是26号元素,Fe原子结构示意图是: ,故答案为:
,故答案为: .
.
 ,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,
,则x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,则B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式分别为3d64s2,则F为Fe元素,(1)A为Si元素,原子核外电子数为14,基态原子的电子排布式是:1s22s22p63s23p2,故答案为:Si;1s22s22p63s23p2;
(2)B为Na元素,故答案为:Na;
(3)C为P元素,最外层有三个成单电子,价电子排布为3s23p3,故答案为:3s23p3;
(4)D为N元素,原子核外电子数为7,价电子排布为2s22p3,价电子轨道表示为:
 ,故答案为:N;
,故答案为:N; ;
;(5)F为Fe元素,是26号元素,Fe原子结构示意图是:
 ,故答案为:
,故答案为: .
.
点评:本题考查结构性质与位置关系、核外电子排布规律、常用化学用语书写等,难度中等,推断元素是解题的关键.

练习册系列答案
相关题目
若NA表示阿佛加德罗常数,下列说法正确的是( )
| A、1 mol氦气分子中含2NA个氦原子 |
| B、25℃时,l L pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA |
| C、1.8 g重水(21H2O)中所含质子的个数为NA |
| D、1L 0.2mol/L的FeCl3溶液中Fe3+的数目为0.2NA |
石墨和金刚石都是碳的单质,1mol石墨在一定条件下可完全转化为金刚石,要吸收QKJ的能量,下列说法正确的是( )
| A、石墨不如金刚石稳定 |
| B、等质量的石墨与金刚石相比,石墨具有的能量高 |
| C、等物质的量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
| D、等物质的量的石墨与金刚石完全燃烧,石墨放出的能量多 |
在标准状况下,将a L HCl(气)溶于1L水中(水的密度为1g?cm-3),得到的盐酸的密度为b g?mL-1,质量分数为w,物质的量浓度为c mol?L-1则下列关系式中正确的是( )
A、w=
| ||
B、w=
| ||
C、C=
| ||
D、b=
|
下列分子式表示的物质一定是纯净物的是( )
| A、CH2O |
| B、C2H6O |
| C、C3H7Cl |
| D、C2H4Cl2 |
在苯和苯酚组成的混合物中,碳元素的质量分数为90% 则混合物中氧元素的质量分数为( )
| A、2.5% | B、5% |
| C、6.5% | D、7.5% |
 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: