题目内容
钛酸钡粉体是电子陶瓷元器件的重要基础原料.工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2?4H2O],煅烧可获得钛酸钡粉体.

(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点).
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 .
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;可循环使用的物质X是 .
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 .

(1)酸浸时发生的反应的离子方程式为
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是
(3)加入H2C2O4溶液时,发生反应的化学方程式为
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、
考点:制备实验方案的设计
专题:实验设计题
分析:由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2?4H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,增大固体的接触面积可提高反应速率;
(2)TiCl4可发生水解反应;
(3)加入H2C2O4溶液生成草酸氧钛钡晶体,同时生成HCl可循环使用;
(4)BaTiO(C2O4)2?4H2O煅烧,发生分解反应.
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,增大固体的接触面积可提高反应速率;
(2)TiCl4可发生水解反应;
(3)加入H2C2O4溶液生成草酸氧钛钡晶体,同时生成HCl可循环使用;
(4)BaTiO(C2O4)2?4H2O煅烧,发生分解反应.
解答:
解:由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2?4H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,离子反应为BaCO3+2H+=Ba2++CO2↑+H2O;为提高BaCO3的酸浸率,可采取的措施为将BaCO3粉碎,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;将BaCO3粉碎;
(2)TiCl4可发生水解反应,则通常将TiCl4溶于浓盐酸,目的是抑制TiCl4的水解,故答案为:抑制TiCl4的水解;
(3)加入H2C2O4溶液生成草酸氧钛钡晶体,反应为BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2?4H2O↓+6HCl,同时生成HCl(或盐酸)可循环使用,
故答案为:BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2?4H2O↓+6HCl;HCl(或盐酸);
(4)BaTiO(C2O4)2?4H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),故答案为:CO2;H2O(g).
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,离子反应为BaCO3+2H+=Ba2++CO2↑+H2O;为提高BaCO3的酸浸率,可采取的措施为将BaCO3粉碎,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;将BaCO3粉碎;
(2)TiCl4可发生水解反应,则通常将TiCl4溶于浓盐酸,目的是抑制TiCl4的水解,故答案为:抑制TiCl4的水解;
(3)加入H2C2O4溶液生成草酸氧钛钡晶体,反应为BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2?4H2O↓+6HCl,同时生成HCl(或盐酸)可循环使用,
故答案为:BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2?4H2O↓+6HCl;HCl(或盐酸);
(4)BaTiO(C2O4)2?4H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),故答案为:CO2;H2O(g).
点评:本题考查物质制备实验,为高频考点,把握物质的性质及流程中的反应为解答的关键,侧重分析、实验能力及混合物分离提纯实验设计能力的考查,题目难度中等.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
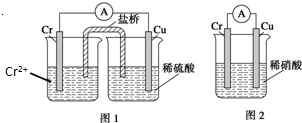 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).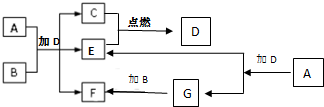 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
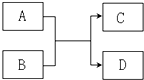 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系: