题目内容
19.中学无机物之间有一些重要的衍变关系,根据下列转化关系按要求填空.(1)金属$\stackrel{O_{2}}{→}$碱性氧化物$\stackrel{H_{2}O}{→}$碱-→盐,满足其中关系的金属有Na(写1种)
(2)非金属$\stackrel{O_{2}}{→}$酸性氧化物$\stackrel{H_{2}O}{→}$酸-→盐,满足其中关系的非金属有C、S(写2种)
(3)A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D(酸或碱),满足其中关系的A有Na、S(写2种)
(4)A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
①若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是4:1.
②若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.A元素在周期表中的位置是第4周期Ⅷ族(填所在周期和族);
(5)甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是C
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2.
分析 (1)金属为Na、K等符合转化关系;
(2)非金属为S、C等符合转化关系;
(3)A为Na,B为氧化钠,C为过氧化钠,D为氢氧化钠,或A为S,B为二氧化硫,C为三氧化硫,D为硫酸等符合转化关系;
(4)①A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应;
②A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
(5)A.甲为焦炭,丁是O2,则乙为CO,丙为CO2;
B.若甲为SO2,丁是氨水,则乙为亚硫酸氢铵,丙为亚硫酸铵
C.若甲为Fe,丁为盐酸,铁和盐酸反应生成氯化亚铁和氢气,不能进一步和盐酸反应;
D.甲为NaOH溶液,丁是CO2,则乙为Na2CO3,丙为NaHCO3.
解答 解:(1)金属为Na、K等符合转化关系,钠与氧气生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠与酸反应得到盐,故答案为:Na;
(2)非金属为S、C等符合转化关系,故答案为:S、C;
(3)A为Na,B为氧化钠,C为过氧化钠,D为氢氧化钠,或A为S,B为二氧化硫,C为三氧化硫,D为硫酸等符合转化关系,故答案为:Na、S;
(4)①A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,反应方程式为C+4HNO3═CO2↑+4NO2↑+2H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1,
故答案为:4:1;
②A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,铁为26号元素,在在元素周期表中的第4周期Ⅷ族,
故答案为:第4周期Ⅷ族;
解:A.甲为焦炭,丁是O2,则乙为CO,丙为CO2,二氧化碳与碳反应生成CO,符合转化关系,故A正确;
B.若甲为SO2,丁是氨水,则乙为亚硫酸氢铵,丙为亚硫酸铵,亚硫酸铵与二氧化硫反应书写亚硫酸氢铵,符合转化关系,故B正确;
C.若甲为Fe,丁为盐酸,铁和盐酸反应生成氯化亚铁和氢气,不能进一步和盐酸反应,故C错误;
D.甲为NaOH溶液,丁是CO2,则乙为Na2CO3,丙为NaHCO3,碳酸氢钠与氢氧化钠反应生成碳酸钠,符合转化关系,故D正确,
故选:C.
点评 本题考查无机物推断,基本属于开放性题目,需要学生熟练掌握元素化合物知识,难度中等.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 用pH试纸测定Na2CO3溶液的pH | |
| B. | 从食盐水中提取NaCl | |
| C. | 用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | |
| D. | 配制100ml 0.1000mol/L的NaCl溶液 |
| A. | 二氧化碳 | B. | 氯气 | C. | 氨气 | D. | 二氧化硫 |
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 测定中和热 | 取0.5mol.L-1的盐酸与0.55mol.L-1的NaOH溶液各50ml混合用量热器测定温度变化. |
| D | 验证浓度对化学平衡的影响 | 向0.1mol.L-1的重铬酸钾溶液中滴几滴浓硫酸观察颜色,再滴几滴NaOH溶液观察颜色变化. |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1mol A+0.5mol B+1.5mol C+0.1mol D | |
| B. | 3mol C+0.5mol D | |
| C. | 2mol A+1mol B+1molD | |
| D. | 0.5mol A+0.25mol B+2.25mol C |
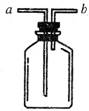 现有如图所示装置,为实现下列实验目的
现有如图所示装置,为实现下列实验目的
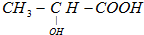 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.


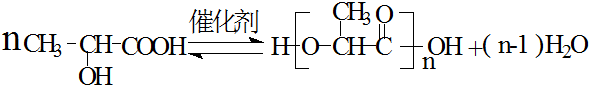 .
.