题目内容
设nA表示阿佛加德罗常数的值.下列说法正确的是( )
| A、3.4g H2O2中含有的共用电子对的数目为0.1NA |
| B、标准状况下,11.2L Cl2通入足量NaOH溶液,转移的电子数目为NA |
| C、常温下,46g乙醇含C-H键数目为5NA |
| D、标准状况下,11.2L NO与11.2L O2的混合气体中含有气体分子的数目为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、双氧水的电子式为: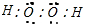 ,0.1mol双氧水中含有0.3mol共用电子对;
,0.1mol双氧水中含有0.3mol共用电子对;
B、标况下11.2L氯气的物质的量为0.5mol,氯气与氢氧化钠溶液的反应,氯气既是氧化剂,也是还原剂;
C、乙醇分子中含有5个碳氢键,1mol碳氢键中含有5mol碳氢键;
D、一氧化氮与氧气反应生成二氧化氮,0.5mol一氧化氮消耗0.25mol氧气,反应后生成0.5mol二氧化氮,氧气剩余0.25mol.
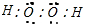 ,0.1mol双氧水中含有0.3mol共用电子对;
,0.1mol双氧水中含有0.3mol共用电子对;B、标况下11.2L氯气的物质的量为0.5mol,氯气与氢氧化钠溶液的反应,氯气既是氧化剂,也是还原剂;
C、乙醇分子中含有5个碳氢键,1mol碳氢键中含有5mol碳氢键;
D、一氧化氮与氧气反应生成二氧化氮,0.5mol一氧化氮消耗0.25mol氧气,反应后生成0.5mol二氧化氮,氧气剩余0.25mol.
解答:
解:A、3.4g双氧水的物质的量为0.1mol,0.1mol双氧水中含有0.3mol共用电子对,含有的共用电子对的数目为0.3NA,故A错误;
B、标况下,11.2L氯气的物质的量为0.5mol,0.5mol氯气与氢氧化钠溶液反应转移了0.5mol电子,转移的电子数目为0.5NA,故B错误;
C、46g乙醇的物质的量为1mol,1mol乙醇中含有5mol碳氢键,含C-H键数目为5NA,故C正确;
D、标准状况下,11.2L NO的物质的量为0.5mol,11.2L O2的物质的量为0.5mol,0.5mol一氧化氮反应消耗0.25mol氧气生成0.5mol二氧化氮,剩余氧气0.25mol;由于二氧化氮与四氧化二氮存在转化平衡,所以无法计算反应后剩余气体的物质的量,故D错误;
故选C.
B、标况下,11.2L氯气的物质的量为0.5mol,0.5mol氯气与氢氧化钠溶液反应转移了0.5mol电子,转移的电子数目为0.5NA,故B错误;
C、46g乙醇的物质的量为1mol,1mol乙醇中含有5mol碳氢键,含C-H键数目为5NA,故C正确;
D、标准状况下,11.2L NO的物质的量为0.5mol,11.2L O2的物质的量为0.5mol,0.5mol一氧化氮反应消耗0.25mol氧气生成0.5mol二氧化氮,剩余氧气0.25mol;由于二氧化氮与四氧化二氮存在转化平衡,所以无法计算反应后剩余气体的物质的量,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握标况下气体摩尔体积及其使用条件;阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| B、标准状况下,11.2L水所含分子数为0.5NA |
| C、同温同体积时,两种气体的压强比等于物质的量之比 |
| D、46gNO2和N2O4的混合物含有的分子数为NA |
下列说法正确的是( )
| A、强电解质溶液的导电能力一定比弱电解质溶液强 |
| B、中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多 |
| C、如果盐酸的浓度是醋酸的两倍,则盐酸的H+浓度也是醋酸的二倍 |
| D、物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO43-不同 |
将2.3g Na和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL.下列说法正确的是( )
| A、整个反应过程中共转移电子0.4 mol |
| B、反应产生的气体在标准状况下的体积是1.12L |
| C、反应所得溶液与足量CO2反应的离子方程式:2AlO-2+CO2+3H2O═2Al(OH)3↓+CO32- |
| D、在稀释、定容操作中用到的全部玻璃仪有:烧杯、玻璃棒、500mL容量瓶 |
用nA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、常温常压下,200g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B、.标准状况下,22.4LCHCI3中含C-H键数目为nA |
| C、.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D、.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
 A、B、C、D、E、X、Y为中学常见的七种物质,它们有如图转化关系(部分产物与反应条件略去):
A、B、C、D、E、X、Y为中学常见的七种物质,它们有如图转化关系(部分产物与反应条件略去):