题目内容
6.下列属于碱性氧化物的是( )| A. | SO2 | B. | MgO | C. | H2O | D. | CO2 |
分析 碱性氧化物是能和酸反应生成盐和水的氧化物,金属氧化物绝大多数为碱性氧化物,碱性氧化物均为金属氧化物,据此分析.
解答 解:A、二氧化硫能和碱反应生成盐和水,故为酸性氧化物,故A错误;
B、氧化镁能和酸反应生成盐和水,故为碱性氧化物,故B正确;
C、水和酸、碱均不能反应生成盐和水,故不是酸性氧化物和碱性氧化物,故C错误;
D、二氧化碳和碱反应生成盐和水,故是酸性氧化物,故D错误.
故选B.
点评 本题考查了酸性氧化物和碱性氧化物的概念以及区别,难度不大,掌握概念是关键.

练习册系列答案
相关题目
2.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. | 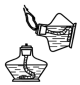 点燃酒精灯 | B. | 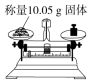 称取氯化钠 | C. | 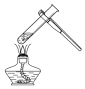 液体加热 | D. |  量取9.5mL的液体 |
11.用固体NaOH配制250mL 0.2mol•L-1的NaOH,下列操作会导致溶液浓度偏高的是( )
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
16.下列说法中正确的是( )
| A. | 各组成元素质量分数相同的烃是同一种烃 | |
| B. | 结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物 | |
| C. | 能使溴的四氯化碳溶液褪色的烃一定是烯烃 | |
| D. | C3H6和C4H8不一定是同系物 |

 .
.