题目内容
12.已知KMnO4$\stackrel{△}{→}$K2MnO4+MnO2+O2↑(未配平);KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平);K2MnO4+HCl(浓)→KCl+MnO2+Cl2↑+H2O(未配平);MnO2+HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+H2O(未配平).取0.04molKMnO4固体加热一段时间后,收集到amolO2,此时KMnO4的分解率为x(分解率=$\frac{已分解的物质的量}{总物质的量}$),在反应后的残留固体中加入足量的浓盐酸并加热充分反应后,又收集到bmolCl2,此时Mn元素全部以Mn2+存在于溶液中.求:(写出计算步骤)
(1)a+b=0.1x-a(用x表示)
(2)a+b的最小值为0.08
(3)当a+b=0.09mol时,0.04molKMnO4固体加热一段时间后所得残留固体的质量为.
分析 (1)KMnO4固体加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,元素Mn获得的电子数等于元素O、Cl失去的电子数,则有:0.04x×(7-2)=4a+2b,整理得a+b=0.1x-a.
(2)每生成1mol氧气转移电子数为4mol,每生成1mol氯气转移电子数为2mol,生成的氯气越多总气体量越大,故在高锰酸钾失去电子数一定的情况下生成的氯气量与总气体量成正比.当高锰酸钾没有分解时,生成氧气为0,即a=0,此时生成氯气最多;当高锰酸钾完全分解生成氧气时,生成氧气最多,而生成氯气最少,并根据方程式求算两种极限思想下的气体的量,进而确定(a+b)的最小值;
(3)根据2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑计算出生成的K2MnO4、MnO2和O2以及剩余的KMnO4的物质的量,根据得失电子数相等找出关系式2KMnO4~5Cl2、K2MnO4 ~2Cl2和MnO2 ~Cl2计算氯气的物质的量,最后根据质量守恒计算残留固体的质量.
解答 解:(1)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到b mol氯气,根据电子转移守恒,整个过程中,元素Mn获得的电子数等于元素O、Cl获得的电子数,根据电子守恒得0.04x×(7-2)=4a+2b,整理得a+b=0.1x-a,
故答案为:0.1x-a;
(2)①当高锰酸钾未分解时,氧气生成量a=0,此时氯气生成量最大,故2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 5
0.04 0.1,则(a+b)=0.1;
②当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.04mol×$\frac{1}{2}$=0.02mol,则(a+b)=0.1-0.02=0.08,故0.08≤a+b≤0.1,故(a+b)的最小值为0.08,
故答案为:0.08;
(3)a+b=0.09mol时,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
2 1 1 1
0.04x 0.04x 0.04x 0.02x,
根据得失电子数相等找出关系式2KMnO4~5Cl2 K2MnO4 ~2Cl2MnO2 ~Cl2
0.04(1-x) $\frac{5}{2}×0.04×(1-x)$ 0.04x 2×0.04x 0.04x 2×0.04x
得 0.02x+$\frac{5}{2}×0.04×(1-x)$+2×0.04x+2×0.04x=0.09mol,解得x=0.5,
残留固体的质量m=0.04mol×158g/mol-0.02×0.5×32g/mol=6g.
答:残留的固体的质量为6g.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意充分利用整个过程中的电子转移守恒解答.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案Ⅰ、与水一样,甲醇也能微弱电离:2CH5OH(l)?CH3OH2++CH3O-,它也存在一个类似Kw的离子积Km,且25℃时MKm=2.0×10-17.往一定量的甲醇中加入金属钠,则有关叙述不正确的是A
A.金属钠与甲醇反应比金属钠与水反应更强烈
B.结合H+的能力CH3O->OH-
C.温度不变,所得溶液中c(CH3O-)和c(CH3OH2+)的乘积为常数
D.所得溶液中c(Na+)+c(CH3OH2+)═c(CH3O-)
Ⅱ、已知在常温下常压下:
①2CH3OH+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②CO(g)+O2(g)═2CO2(g)△H=-566.0KJ/mol
③H2O(g)═H2O(l)△H=-44.0KJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为442.8KJ.
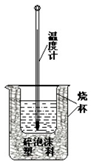
Ⅲ、某同学设计了一个酸性甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1.
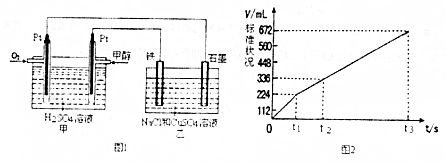
(1)写出甲中通入甲醇一极的电极反应式CH3OH-6e-+H2O=CO2↑+6H+.
(2)图2表示乙中阳极(选填“阴”或“阳”)产生气体的体积与电解时间的关系.当该极产生336mL气体时,理论上甲中消耗O2 224mL(标况).
Ⅳ、工业上常用两种方法生产甲醇:
方法一:CO(g)+2H2(g)?CH3OH(g)△H<0
(1)能说明该反应已达平衡状态的是B(填写序号字母).
A.n(CO):n(H2):n(CH3OH)=1:2:1
B.恒温恒容,气体总压强保持不变
C.H2的消耗速率与CH3OH的生成速率之比为2:1
D.恒温恒容,混合气体的密度保持不变
(2)下列措施能使容器中$\frac{n(C{H}_{3}OH)}{c(CO)}$增大的是C.
A.升高温度
B.将CH3OH从容器中分离出去一部分
C.体积不变,充入氢气
D.选用更有效的催化剂
E.体积不变,充入氦气,使体系压强增大
方法二:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0KJ/mol
某温度下,在容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,达到平衡时的能量变化数据如表:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
(2)a=19.6;B容器中反应达到平衡时,CH3OH的转化率是40%.
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,再次平衡时CH3OH的物质的量大于1.2mol.(选填“大于”、“小于”或“等于”)
| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气. .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.


