题目内容
14.在2L的密闭容器中发生反应:3A(g)+2B(g)?C(g)+4D(g),反应进行10s后,B减少了0.6mol,则在10s内,该反应的平均反应速率表示正确的是( )| A. | v(A)=0.09mol•L-1•s-1 | B. | v(B)=0.06mol•L-1•s-1 | ||
| C. | v(C)=0.9mol•L-1•min-1 | D. | v(D)=3.6mol•L-1•min-1 |
分析 v(B)=$\frac{\frac{△n}{V}}{△t}$,再根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算其它物质的反应速率,据此分析解答.
解答 解:v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol•L-1•s-1,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,
A.v(A)=$\frac{3}{2}$v(B)=$\frac{3}{2}$×0.03mol•L-1•s-1=0.045mol•L-1•s-1,故A错误;
B.v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol•L-1•s-1,故B错误;
C.v(C)=$\frac{1}{2}$v(B)=$\frac{1}{2}$×0.03mol•L-1•s-1=0.015mol•L-1•s-1=0.9mol•L-1•min-1,故C正确;
D.v(D)=2v(B)=0.06mol•L-1•s-1=3.6mol•L-1•min-1,故D正确;
故选CD.
点评 本题考查化学反应速率有关计算,为高频考点,侧重考查学生分析计算能力,明确反应速率与计量数之间的关系是解本题关键,注意单位之间的换算,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
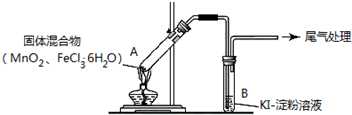
实验操作和现象:
(1)现象 i 中的白雾是盐酸小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象 ii 和a 中的黄色气体,溶液均变红.通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
①方案1 的洗气瓶C中盛放的试剂是饱和NaCl溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象 ii 和a 中的黄色气体,溶液均变红.通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
| 方案1 | 在A、B 间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B 中KI淀粉溶液替换为NaBr 溶液;检验 Fe 2+ | B中溶液呈浅橙红色;未检出Fe 2+ |
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
5.下列化学用语正确的是( )
| A. | CO2的电子式: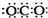 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 甲烷的结构简式:CH4 | D. | 乙烯分子的球棍模型: |
2.某烷烃相对分子质量为86,与氯气反应生成的一氯代物只有两种,其结构简式是( )
| A. | CH3(CH2)4CH3 | B. | C2H5C(CH3)3 | C. | (C2H5)2CHCH3 | D. | (CH3)2CHCH3 |
12.关于σ键和π键的比较,下列说法不正确的是( )
| A. | σ键是轴对称的,π键是镜像对称的 | |
| B. | σ键是“头碰头”式重叠,π键是“肩并肩”式重叠 | |
| C. | σ键不能断裂,π键容易断裂 | |
| D. | H原子只能形成σ键,O原子可以形成σ键和π键 |
9.下列7种物质中,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色的是①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2( )
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
10.A、B是相对分子质量不相等的两种有机物,无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,产生水的质量也不变.下列各种化合物中符合这种条件的是( )
| A. | 乙酸和甲酸甲酯 | B. | 乙烷和乙醛 | ||
| C. | 甲醛和麦芽糖(C12H22O11) | D. | 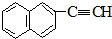 和 和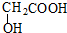 |
 .
.