题目内容
7.下列化学实验事实及其结论都正确的是( )| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | 酸性:H2SiO3>H2CO3 |
| C | 向氯化铝溶液中滴加氢氧化钠溶液,观察到先产生白色沉淀后沉淀溶解 | 氢氧化铝可溶于强碱 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点髙 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硅与HF反应,为其特性,与强酸不反应;
B.比较酸性可利用溶液中强酸制弱酸的原理;
C.氢氧化铝具有两性,可溶于强碱;
D.氧化铝的熔点高,包裹在Al的外面.
解答 解:A.二氧化硅与HF反应,为其特性,与强酸不反应,可与NaOH反应生成盐和水,则二氧化硅为酸性氧化物,故A错误;
B.比较酸性可利用溶液中强酸制弱酸的原理,不能利用高温下固体之间的反应比较,故B错误;
C.氢氧化铝具有两性,可溶于强碱,则向氯化铝溶液中滴加氢氧化钠溶液,观察到先产生白色沉淀后沉淀溶解,故C正确;
D.氧化铝的熔点高,包裹在Al的外面,则铝箔在酒精灯火焰上加热熔化但不滴落,结论不合理,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、反应原理为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
18.下列有机反应方程式中,不正确的是( )
| A. | 丙烯与Br2加成:CH2═CHCH3+Br2→CH2BrCH2CH2Br | |
| B. | 甲烷与Cl2发生取代反应:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 催化裂化:C16H34$→_{△}^{催化剂}$C8H16+C8H18 | |
| D. | 淀粉水解:(C6H10O5)n+nH2O$\stackrel{催化剂}{→}$nC6H12O6 |
15.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是( )
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
2.下列关于化学与生活的说法不正确的是( )
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车 | |
| B. | 高纯硅可以将太阳能直接转化为电能 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 工业上Cl2用与石灰乳反应制备漂白粉 |
12.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y 和Z最外层电子数之和与W的最外层电子数相同.25℃时0.1mol/LX和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y和其它四种元素均可形成至少两种化合物(两种元素组成) | |
| B. | 原子半径由大到小排列的顺序是:R>W>Z>Y>X | |
| C. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比均为2:1 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
19.下列物质不属于合金的是( )
| A. | 黄铜 | B. | 钢铁 | C. | 硬铝 | D. | 水银 |
17.已知:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266KJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266KJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | 2Na2O2(s)+2CO2( s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| B. | CO的燃烧热为283 kJ | |
| C. | 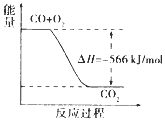 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×l023 |
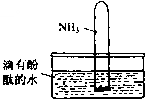 氨气是一种重要的化工原料,氨态氮肥是常用的肥料.
氨气是一种重要的化工原料,氨态氮肥是常用的肥料. NH3•H2O
NH3•H2O NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.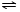 NH3•H2O+H+
NH3•H2O+H+