题目内容
20.现有下列物质:①Cl2、②Na2O2、③NaOH、④HCl、⑤H2O2、⑥MgF2、⑦NH4Cl(1)只有离子键构成的物质是⑥;
(2)只有极性键构成的物质是④;
(3)只有非极性键构成的物质是①;
(4)只有非金属元素组成的离子化合物是⑦;
(5)由极性键和非极性键构成的物质是⑤;
(6)由离子键和极性键构成的物质是③⑦;
(7)由离子键和非极性键构成的物质是②;
(8)属于离子化合物的是②③⑥⑦;
(9)属于共价化合物的是④⑤.
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①Cl2中Cl-Cl原子之间只存在非极性键,为单质;
②Na2O2中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物;
④HCl分子中H-Cl原子之间只存在极性键,为共价化合物;
⑤H2O2中H-O之间存在极性键、O-O原子之间存在非极性键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N-H原子之间存在极性共价键,为离子化合物;
(1)通过以上分析知,只含离子键的是⑥,故选⑥;
(2)只有极性键构成的物质是④,故选④;
(3)只有非极性键构成的物质是①,故选①;
(4)只有非金属元素组成的离子化合物是⑦,故选⑦;
(5)由极性键和非极性键构成的物质是⑤,故选⑤;
(6)由离子键和极性键构成的物质是③⑦,故选③⑦;
(7)由离子键和非极性键构成的物质是②,故选②;
(8)属于离子化合物的是②③⑥⑦,故选②③⑥⑦;
(9)属于共价化合物的是④⑤,故选④⑤.
点评 本题考查化合物和化学键的判断,为高频考点,侧重考查学生分析判断能力,明确物质构成微粒及微粒之间作用力是解本题关键,注意不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
10.下列各组离子在溶液中能大量共存的是( )
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
11.已知115号元素的一种核素为289X,下列有关115号元素的有关叙述正确的是( )
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
8.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3;CKAl(SO4)2.
(2)写出过量E滴入到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)在A溶液中加澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)写出检验D中阴离子的方法取样,先加盐酸,再滴加氯化钡溶液.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3;CKAl(SO4)2.
(2)写出过量E滴入到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)在A溶液中加澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)写出检验D中阴离子的方法取样,先加盐酸,再滴加氯化钡溶液.
5.下列物质与NaOH的酚酞溶液共热时,能使溶液颜色褪去的有( )
①乙酸 ②乙醇③乙酸乙酯④氯乙烷.
①乙酸 ②乙醇③乙酸乙酯④氯乙烷.
| A. | ① | B. | ②③ | C. | ②④ | D. | ①③④ |
2.钛被誉为“21世纪金属”,具有多种优良性能,工业上冶炼金属钛的反应原理为4Na+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl.下列说法正确的是( )
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
 .
.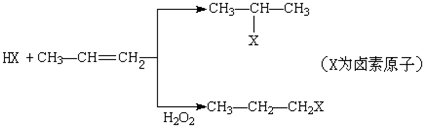
 的物质,该物质是一种香料.
的物质,该物质是一种香料.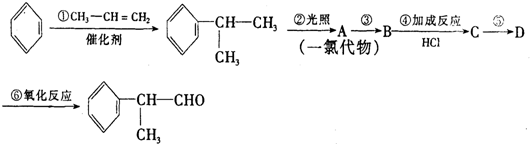
 ,
, .
.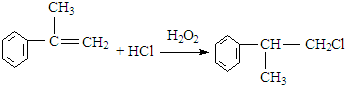 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):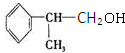 +NaCl.
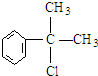
+NaCl.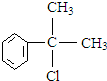 的水解产物
的水解产物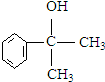 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.