题目内容
可逆反应:2HI(g)?H2(g)+I2(g);△H>0.在密闭容器中进行,当达到平衡时欲使混合气体的颜色加深,应采取的措施( )
| A、增大容器体积 |
| B、升高温度 |
| C、加入催化剂 |
| D、充入H2气体 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:对于可逆反应:2HI(g)?H2(g)+I2(g);△>0,要使达平衡时合气体的颜色加深,平衡向生成碘蒸气的方向移动,由此分析解答.
解答:
解:A、增大容器体积,平衡不移动,但碘蒸气的浓度变小,混合气体的颜色变浅,故A错误;
B、升高温度,平衡正向移动,混合气体的颜色加深,故B正确;
C、加入催化剂,平衡不移动,混合气体的颜色无变化,故C错误;
D、充入H2气体,平衡逆向移动,混合气体的颜色变浅,故D错误;
故选:B.
B、升高温度,平衡正向移动,混合气体的颜色加深,故B正确;
C、加入催化剂,平衡不移动,混合气体的颜色无变化,故C错误;
D、充入H2气体,平衡逆向移动,混合气体的颜色变浅,故D错误;
故选:B.
点评:本题考查化学平衡的移动知识,学生要学会分析外界条件的变化引起平衡的移动,比较容易.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
对于SO2的接触氧化反应,有学生绘制了如下四个图,其中正确的是( )
A、 |
B、 |
C、 |
D、 |
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O下列说法正确的是( )
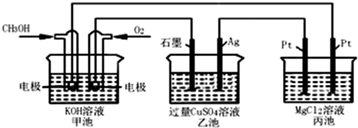

| A、甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B、甲池通入CH3OH的电极反应为CH3OH-6e?+2H2O═CO32?+8H+ |
| C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D、甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28g固体 |
 提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
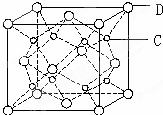 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则: