题目内容
13.在实验室制取乙烯的装置图(如图)中,仪器A的名称是烧瓶.A中除了需要加入的两种反应试剂外,还要加入碎瓷片(或沸石).其作用为避免混和液在受热沸腾时剧烈跳动(暴沸).反应的化学方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.浓硫酸的作用为催化剂和脱水剂.实验后期当A中溶液颜色变为黑色时,将制得的乙烯气体直接通入溴水中使溴水褪色,能否证明乙烯发生了加成反应?不能(填“能”或“不能”),原因是杂质气体中混有SO2气体,SO2有还原性,也能使Br2水褪色,因而不能确定是乙烯与溴水发生加成反应而使溴水褪色..为了获得乙烯气体(可含水蒸气),应该在发生装置与性质检验装置之间安装洗气瓶,瓶内装入NaOH 溶液 (填试剂).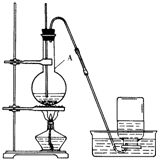
分析 依据仪器的形状说出仪器的名称;
乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,为防止液体爆沸,应加入碎瓷片或者沸石;
浓硫酸具有脱水性,制备的乙烯中含有杂质二氧化硫,依据二氧化硫的还原性,对乙烯的检验造成干扰,据此解答.
解答 解:依据图中A形状可知,A为烧瓶;乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;为防止爆沸,应在烧瓶中加入碎瓷片(或沸石);反应中浓硫酸作用为:催化剂、脱水剂;实验后期当A中溶液颜色变为黑色时,是因为浓硫酸具有脱水性,强氧化性,使乙醇脱水炭化,并发生氧化还原反应生成二氧化硫,二氧化硫具有还原性,能够使溴水褪色,对乙烯的检验造成干扰,所以将制得的乙烯气体直接通入溴水中使溴水褪色,不能证明乙烯发生了加成反应;二氧化硫为酸性氧化物,能够与氢氧化钠反应,乙烯不溶于水,与氢氧化钠溶液不反应,所以为了获得乙烯气体(可含水蒸气),应该在发生装置与性质检验装置之间安装洗气瓶,瓶内装入NaOH 溶液;
故答案为:烧瓶;碎瓷片(或沸石);避免混和液在受热沸腾时剧烈跳动(暴沸);C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;催化剂和脱水剂;不能;杂质气体中混有SO2气体,SO2有还原性,也能使Br2水褪色,因而不能确定是乙烯与溴水发生加成反应而使溴水褪色;洗气;NaOH 溶液.
点评 本题考查了乙烯的实验室制备及性质的检验,熟悉乙醇的结构与性质是解题关键,注意浓硫酸的作用,注意二氧化硫对乙烯性质检验的干扰,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气.但电解前要进行粗盐精制.试回答下列问题:
资料卡片:
(1)选择试剂以除去下表所列的可溶性杂质.
(2)精制过程既要将杂质离子Ca2+、Mg2+、SO42-完全沉淀,又要保证不引入新的杂质,为此你认为加入所选沉淀剂的合理顺序为:Ⅱ、Ⅲ、Ⅰ(填序号).
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-.其中盐酸除去CO32-的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.
资料卡片:
| 一些物质的溶解性 | ||||
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| 杂质 | 加入的试剂 |
| CaCl2 | ⅠNa2CO3 |
| MgCl2 | ⅡNaOH |
| 硫酸盐 | ⅢBaCl2 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-.其中盐酸除去CO32-的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.
18.孔雀石的主要成分为Cu2(OH)2CO3还含少量二价铁和三价铁的氧化物及硅的氧化物.如图是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图: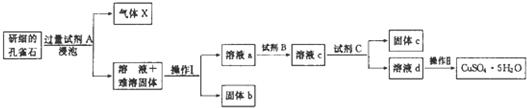
(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D(填选项序号);
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.

(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
5. 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.
C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低碳酸氢钠溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混有的HCl气体.
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体.请通过简单实验判断该晶体是碳酸氢钠晶体晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3.
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为70%.
 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.
C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混有的HCl气体.
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体.请通过简单实验判断该晶体是碳酸氢钠晶体晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3.
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为70%.
3.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过BaCl2溶液( )
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ②④①③⑤ |

