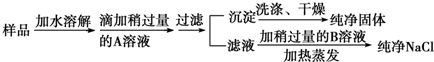
题目内容
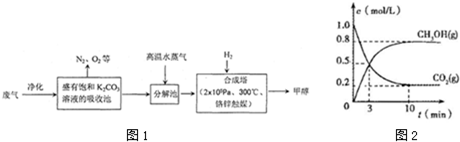
1.工业合成氨与制备硝酸一般可连续生产,回答下列问题:(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 (1)CO+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
根据K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$计算化学平衡常数;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(①+②)×$\frac{1}{2}$来书写热化学方程式;
(3)燃料电池中,燃料做负极,发生氧化反应.
解答 解:(1)利用三段式计算,
CO+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
化学平衡常数K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.28}$=1,
故答案为:1;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(①+②)×$\frac{1}{2}$,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题主要考查较为综合,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目涉及化学平衡常数的计算、盖斯定律的应用、原电池电极反应的书写等知识,中等难度,答题时注意化学原理知识的灵活运用.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案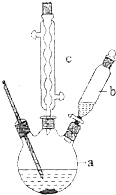 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: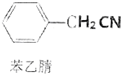 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$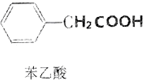 +NH4HSO4
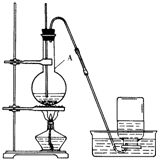
+NH4HSO4 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
. “低碳经济”已成为科学家研究的主要课题之一.
“低碳经济”已成为科学家研究的主要课题之一.