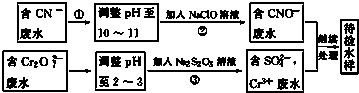
题目内容
20.化学实验是研究物质性质的基础.(1)下列有关实验操作或测量数据不合理的是ABD(填序号).
A.用铁坩埚加热CuSO4•5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
D.用已知浓度盐酸滴定未知浓度氨水,用酚酞做指示剂.
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度.
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1mol•L-1 KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,消耗KMnO4(H2SO4酸化)溶液体积Vml,计算.
①下列滴定方式中,最合理的是(夹持部分略去)b(填字母序号).
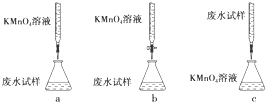
②达到滴定终点时现象是:溶液由无色变为紫色,其半分钟不褪色.SO32-的浓度的表达式为:0.0125Vmol/L.
(3)已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能进行完全,据此判断下列叙述正确的是C
A、BeCl2 溶液的 PH<7,将其蒸干灼烧后得到的残留物为 Be(OH)2
B、Na2BeO2 溶液的 PH>7,将其蒸干灼烧后得到的残留物为 BeO
C、Be(OH)2 既能溶解于盐酸,又能溶解于 NaOH 溶液
D、Na2BeO2 溶液中守恒关系有:CNa++CH+=2C BeO22_+C OH-+C H2BeO2
E、Li、Be、B 三种元素的第一电离能异常小的 B 元素.
分析 (1)A.铁能够与CuSO4发生置换反应;
B.浓硫酸有脱水性,可以使pH试纸脱水碳化;
C.量筒的最小读数为0.1;
D.恰好反应时生成氯化铵,溶液为酸性,酚酞的变色范围为8-10,不能使用酚酞做指示剂;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,废水样品中含有一定量的Na+、CO32-、SO32-,呈碱性,溶液由无色变为有色,现象明显;
②根据滴定结束时溶液颜色变化判断滴定终点现象;根据反应方程式及高锰酸钾的物质的量计算出亚硫酸根离子的物质的量,再根据c=$\frac{n}{V}$计算出其浓度;
(3)A.BeCl2为强酸弱碱盐,水解呈酸性,将其蒸干,灼烧后可得残留物BeO;
B.Na2BeO2为强碱弱酸盐,水解呈碱性,将其蒸干,灼烧后可得残留物Na2BeO2;
C.Be(OH)2性质类似于氢氧化铝,具有两性;
D.根据Na2BeO2溶液中的电荷守恒进行判断;
E.同一同期中核电荷数越大,第一电离能越大.
解答 解:(1),A.用铁坩埚加热CuSO4•5H2O,铁能够与CuSO4发生置换反应,会造成误差,故A错误;
B.不能用干燥的pH试纸测定浓硫酸的pH,浓硫酸有脱水性,可以使pH试纸脱水碳化,不能与标准比色卡比较,故B错误;
C.量筒精确到0.1,可量取16.8mL的Na2CO3溶液,故C正确;
D.用已知浓度盐酸滴定未知浓度氨水,恰好反应时溶液为酸性,而酚酞的变色范围为8-10,所以不能用酚酞做指示剂,故D错误;
故答案为:ABD;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,溶液由无色变为有色,现象明显,应用高锰酸钾滴定废水,
故答案为:b;
②高锰酸钾能将亚硫酸根离子氧化为硫酸根离子:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,当反应结束后,溶液由无色变为紫色,所以滴定终点的现象为:溶液由无色变为紫色,其半分钟不褪色;
VmL 0.1mol•L-1 KMnO4溶液中含有高锰酸钾的物质的量为:0.1mol/L×V×10-3L=V×10-4mol,结合反应可知20mL该亚硫酸钠溶液中含有亚硫酸根离子的物质的量为:V×10-4mol×$\frac{5}{2}$=2.5V×10-4mol,所以该亚硫酸钠溶液的浓度为:$\frac{2.5V×1{0}^{-4}mol}{0.02L}$=0.0125Vmol/L,
故答案为:溶液由无色变为紫色,其半分钟不褪色;0.0125Vmol/L;
(3)A.BeCl2为强酸弱碱盐,水解呈酸性,溶液的pH<7,将其蒸干,HCl挥发,水解彻底,得到Be(OH)2,灼烧后可得残留物BeO,故A错误;
B.Na2BeO2溶液水解呈碱性,溶液pH>7,将其蒸干,水解得到的氢氧化钠又与Be(OH)2反应得到Na2BeO2,灼烧后可得残留物Na2BeO2,故B错误;
C.Be(OH)2性质类似于氢氧化铝,具有两性,则既能溶于盐酸,又能溶于NaOH溶液,故C正确;
D.Na2BeO2溶液中存在电荷守恒:c(Na+)+c(H+)=2c(BeO22-)+c(OH-)+c(HBeO2-),由于c(HBeO2-)>c(H2BeO2),故c(Na+)+c(H+)>2c(BeO22-)+c(OH-)+c(HBeO2-),故D错误;
E.Li、Be、B三种元素处于同一周期,原子序数越大,第一电离能越大,则第一电离能最小的Li元素,故E错误;
故答案为:C.
点评 本题考查了探究物质含量的方法,题目难度中等,试题涉及化学实验基本操作方法的判断、中和滴定操作步骤及计算、盐的水解原理及其应用等知识,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力.

| A. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ/mol | |
| B. | 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-57.3 kJ/mol | |
| C. | 2C8H18(g)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518 kJ/mol | |
| D. | C8H18(l)+O2(g)═8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
| A. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| B. | 容量瓶洗涤后残留蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 现代化学分析测试中,常借助一些仪器来分析化学物质组成.例如,可用元素分析仪确定C、H、O等元素,用原子吸收光谱确定物质中的有机原子团,用红外光谱仪确定物质中含有哪些金属元素 | |
| C. | 我国现已逐渐用二氧化氯取代氯气对饮用水进行消毒 | |
| D. | 今年夏天,杭州持续高温出现了不同程度的旱情,为缓解旱情可以用干冰或溴化银进行人工降雨 |
| A. | 0.1mol | B. | 0.2mol | C. | 0.15mol | D. | 0.22mol |
| A. | 甲烷与氯气混合光照 | B. | 乙烯加聚 | ||
| C. | 乙烯与氯化氢加成 | D. | CH3CH=CH2与H2O加成 |
 H2O2:
H2O2: MgO:
MgO: N2:
N2: