题目内容
10.焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如图: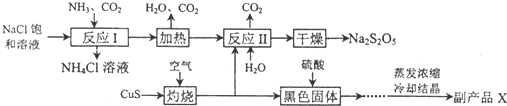
已知:反应II包含2NaHSO3═Na2S2O5+H2O等多步反应.
(1)反应I的总化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应I进行时应先通入的气体是NH3,反应I产生的NH4Cl可用作氮肥.
(2)灼烧时发生反应的化学方程式为2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,若灼烧时生 成SO21.12×l06 L(标准状况下),则转移电子3×l05mol.
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52-+2H+=2SO2↑+H2O;
(4)副产品X的化学式是CuSO4•5H2O,在上述流程中可循环使用的物质是CO2;
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为2:1,检验产品中含有碳酸钠杂质所需试剂①④⑤(填编号).
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸.
分析 反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5,
(1)根据流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;氯化铵常用作氮肥;
(2)CuS与氧气反应生成黑色氧化铜和二氧化硫气体,根据化学方程式可计算出转移电子的物质的量;
(3)Na2S2O5中硫元素的化合价为+4价,生成二氧化硫化合价没变;
(4)氧化铜与硫酸反应生成硫酸铜,结晶得出硫酸铜晶体;根据流程图可知,可循环使用的物质是二氧化碳;
(5)反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2 SO2+H2O=2NaHSO3+CO2,为了控制杂质,二氧化硫与碳酸氢钠应按反应方程式中比例关系反应;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,据此答题.
解答 解:(1)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出,氯化铵常用作氮肥,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3;氮肥;
(2)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,在该反应中每产生2mol二氧化硫则转移12mol电子,所以生成SO21.12×l06 L(标准状况下)即5×l04 mol,则转移电子3×l05 mol
故答案为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2;3×l05;
(3)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O;
(4)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4•5H2O,根据流程图可知,可循环使用的物质是CO2,
故答案为:CuSO4•5H2O;CO2;
(5)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1,检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,故选①④⑤,
故答案为:2:1;①④⑤.
点评 本题考查了物质置制备的实验方案分析,主要是物质性质的理解应用,离子方程式书写方法,注意试剂的选择和实验操作的目的,掌握基础是解题关键,题目难度中等.

| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
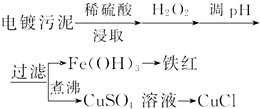
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.
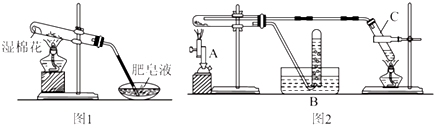
(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.
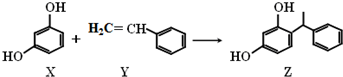
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.