题目内容
9.将3.2克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标况下),则所消耗硝酸的物质的量是( )| A. | 0.1mol | B. | 0.2mol | C. | 0.15mol | D. | 0.22mol |
分析 铜与硝酸反应中硝酸呈酸性和氧化性,所以所消耗硝酸的物质的量是两者之和.
解答 解:n(Cu)=$\frac{m(Cu)}{M(Cu)}$=$\frac{3.2g}{64g/mol}$=0.05mol铜粉生成硝酸铜,要消耗2×0.05mol=0.1mol的硝酸;2.24L气体是NO和NO2的混合物,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,则所消耗的硝酸为0.1+0.1=0.2mol,
故选B.
点评 本题考查化学方程式的计算,难度不大,注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键.

练习册系列答案
相关题目
19.KMnO4是一种重要的氧化剂.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O.
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.0400mol•L的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
17.能大量共存于溶液中的离子组有( )
| A. | Al3+、Na+、AlO2-、NO3-、Cl- | B. | Cl-、HCO3-、OH-、Na+、SO42- | ||
| C. | Ba2+、OH-、Cl-、K+、NO3- | D. | Fe2+、H+、Na+、NO3-、SO42- |
4.下列有关热化学方程式的叙述正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,则氢气燃烧热为285.8kJ•mol-1 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 已知2SO2(g)+O2(g)?2SO3(g);△H=-QkJ•mol-1(Q>0),则将128gSO2(g)和足量O2置于一密闭容器中,充分反应后放出QkJ的热量 |
14.下列离子方程式正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-═NH3•H2O | |
| D. | 铜片加入稀HNO3中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
18.食用醋中含有乙酸.下列关于乙酸的说法不正确的是( )
| A. | 结构简式为:CH3COOH | B. | 乙酸又称为醋酸 | ||
| C. | 可与金属Na反应生成H2 | D. | 分子中原子之间只存在单键 |
19.钢铁厂在冷轧过程中会产生高浓度酸性含铁废水,主要含有H+、Cl-、Fe2+、Fe3+等,其处理的主要工艺流程如下:
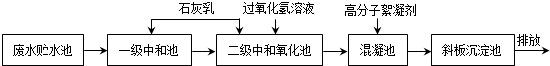
请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a.腐蚀水利设施 b.影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氢的主要作用是b(填字母).
a.还原剂 b.氧化剂
(4)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
稀释后的溶液中c(Fe3+)=0.12 mol/L.

请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a.腐蚀水利设施 b.影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氢的主要作用是b(填字母).
a.还原剂 b.氧化剂
(4)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol/L) | 0.16 | 0.94 | 0.12 |