题目内容
标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1)10Al+6NaNO3+6H2O=4Al(OH)3+6NaAlO2+3N2↑氧化剂是 ,还原剂是
(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O氧化剂是 ,还原剂是 .
(1)10Al+6NaNO3+6H2O=4Al(OH)3+6NaAlO2+3N2↑氧化剂是
(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O氧化剂是
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)10Al+6NaNO3+6H2O=4Al(OH)3+6NaAlO2+3N2↑中N元素化合价降低,被还原,NaNO3为氧化剂,Al元素化合价升高,被氧化,为还原剂;
(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O中Cl元素化合价降低,被还原,NaClO为氧化剂,Fe元素化合价升高,被氧化,FeCl3为还原剂.
(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O中Cl元素化合价降低,被还原,NaClO为氧化剂,Fe元素化合价升高,被氧化,FeCl3为还原剂.
解答:
解:(1)10Al+6NaNO3+6H2O=4Al(OH)3+6NaAlO2+3N2↑中N元素化合价降低,被还原,NaNO3为氧化剂,则N元素得到6×5e-,Al元素化合价升高,被氧化,为还原剂,Al元素失去10×3e-;则电子转移数目和方向可表示为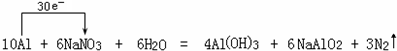 ;
;
故答案为:NaNO3;Al;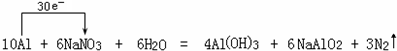 ;
;
(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O中Cl元素化合价降低,被还原,NaClO为氧化剂,则Cl元素得到3×2e-;Fe元素化合价升高,被氧化,FeCl3为还原剂,则Fe元素失去电子数为2×3e-,则电子转移数目和方向可表示为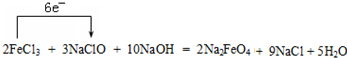 ;
;
故答案为:FeCl3;NaClO;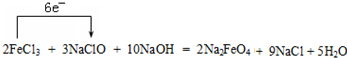 .
.
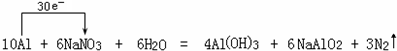 ;
;故答案为:NaNO3;Al;
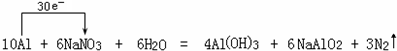 ;
;(2)2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O中Cl元素化合价降低,被还原,NaClO为氧化剂,则Cl元素得到3×2e-;Fe元素化合价升高,被氧化,FeCl3为还原剂,则Fe元素失去电子数为2×3e-,则电子转移数目和方向可表示为
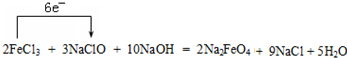 ;
;故答案为:FeCl3;NaClO;
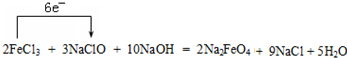 .
.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
相关题目
下面关于电解质的叙述中正确的是( )
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
一氧化碳还原氧化铜:CO+CuO
Cu+CO2,在该反应中( )
| ||
| A、CuO作还原剂 |
| B、CO作氧化剂 |
| C、铜元素的化合价降低 |
| D、碳元素的化合价降低 |
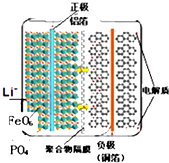 磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6
磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6| 放电 |
| 充电 |
| A、磷酸铁锂电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中 |
| B、放电时负极反应:C6Li-xe-═6C+xLi+ |
| C、充电时阳极反应:LiFePO4-xe-═Li1-xFePO4+xLi+ |
| D、若用该电池电解精炼粗铜,阳极质量减少12.8g时,则电池中通过聚合物隔膜的Li+数目为0.4NA |
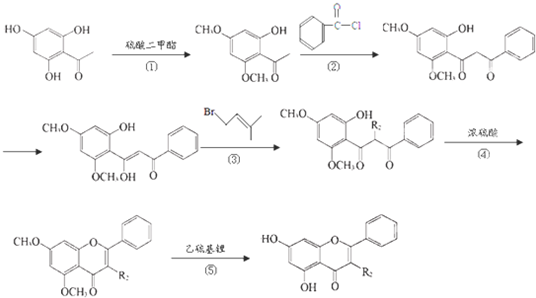
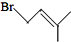 的同分异构体有
的同分异构体有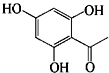 说法正确的是
说法正确的是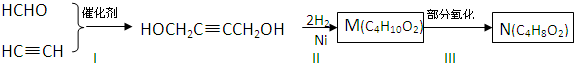
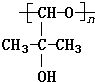
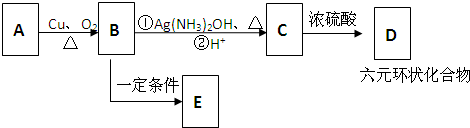
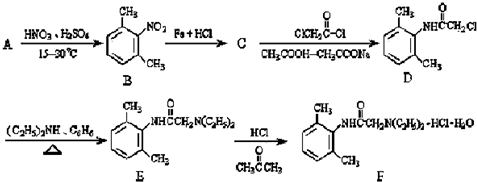
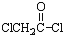 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: