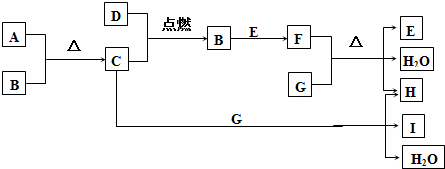
题目内容
5.下列叙述正确的是( )| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-═4OH- | |
| C. | 向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中c(Na+)=c(CH3COO-) | |
| D. | 0.1 mol/L NH4Cl溶液中,c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-) |
分析 A、金属腐蚀时金属原子失去电子,化合价升高;
B、金属的吸氧腐蚀中,负极上是金属失电子的氧化反应;
C、根据电荷守恒分析;
D、NH4Cl溶液中电荷守恒为c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-)+c(OH-).
解答 解:A、金属腐蚀就是金属原子失去电子,化合价升高被氧化的过程,故A错误;
B、钢铁吸氧腐蚀时,正极反应式为:2H2O+O2+4e-═4OH-,负极上是Fe-2e-=Fe2+,故B错误;
C、向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中存在电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),pH=7时c(H+)=c(OH-),则c(Na+)=c(CH3COO-),故C正确;
D、NH4Cl溶液中电荷守恒为c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-)+c(OH-),所以c(NH${\;}_{4}^{+}$)+c(H+)>c(Cl-),故D错误;
故选C.
点评 本题考查学生金属的腐蚀和防护、溶液中离子浓度大小比较,注意原电池原理的应用、金属腐蚀的实质、电极方程式的书写以及电荷守恒的应用,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
20. 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0~16 h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| B. | 0~25 h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
10.常温下,下列有关叙述正确的是( )
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH${\;}_{4}^{+}$)大小顺序为:①>②>③ | |
| D. | 10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 mL |
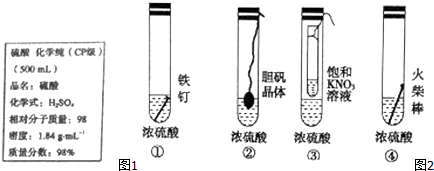
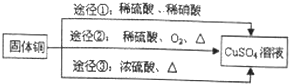
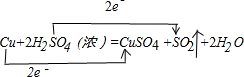 ,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.
,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.