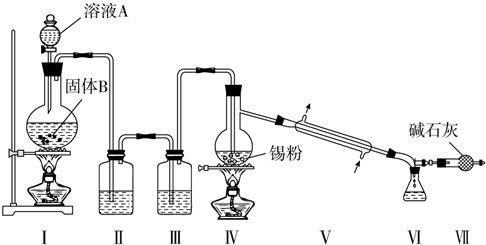
题目内容
10.下列有关实验操作、现象和结论正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液由浅绿色变为黄色,说明加入的气体具有氧化性,可能为氧气或臭氧,不一定为氯气;
B.品红溶液褪色,说明该气体具有漂白性,可能为氯气和臭氧,不一定为二氧化硫;
C.CuO粉末由黑变红,该气体具有还原性,可能为CO或氢气;
D.将某气体与湿润的红色石蕊试纸接触,试纸变蓝,说明该气体为碱性气体,一定为氨气.
解答 解:A.将某气体通入FeCl2溶液中,溶液由浅绿色变为黄色,气体可能是O2、O3等,不一定为Cl2,故A错误;
B.将某气体通入品红溶液中,品红溶液褪色,气体可能是Cl2、O3等,不一定为SO2,故B错误;
C.将某气体通过灼热的CuO粉末,粉末由黑变红,该气体可能为CO,不一定为H2,故C错误;
D.将某气体与湿润的红色石蕊试纸接触,试纸变蓝色,该气体为碱性气体,只能为氨气,故D正确;
故选D.
点评 本题考查了实验方案的评价,题目难度中等,侧重考查常见气体性质及检验,明确常见气体的化学性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
14.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3molX和1molY在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3molX和1molY在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
1.有4.8g CuO、Fe2O3组成的混合物与充足的CO于加热条件下充分反应,得到m g固体,反应后全部气体用0.6mol•L-1 Ba(OH)2溶液100mL处理,有白色沉淀生成,又知反应后生成的气体质量为3.52g.下列有关说法正确的是( )
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
5.在四个不同容器中,在不同的条件下进行合成氨的反应:N2+3H2?2NH3,根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
15. 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+ | |
| B. | 该电池工作时,盐桥中K+向石墨电极定向移动 | |
| C. | 若用此电池电解饱和食盐水制取Cl2,当铜电极的质量减少6.4g时,产生氯气的体积为2.24 L | |
| D. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
20.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.
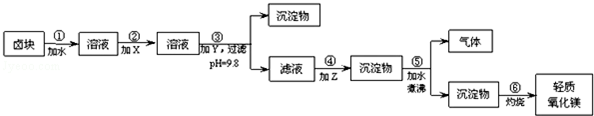
若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:(1)25℃,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14,
(2)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
(3)原料价格表
(1)请设计实验证明卤块中含有Fe3+取样,加水溶解,往所得溶液中滴加硫氰化钾溶液,若溶液变红,则说明卤块中含铁离子
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO)
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑤中发生的反应是MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑
(4)步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=4×10-8mol/L.

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:(1)25℃,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14,
(2)Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
(3)原料价格表
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO)
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑤中发生的反应是MgCO3+H2O$\frac{\underline{\;煮沸\;}}{\;}$Mg(OH)2+CO2↑
(4)步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=4×10-8mol/L.